题目内容
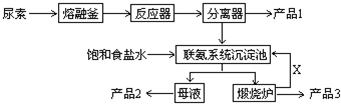
15.工业上利用含有一定浓度的I2和CuSO4溶液的工业废水制备饲料添加剂Ca(IO3)2,其具体生产流程如下: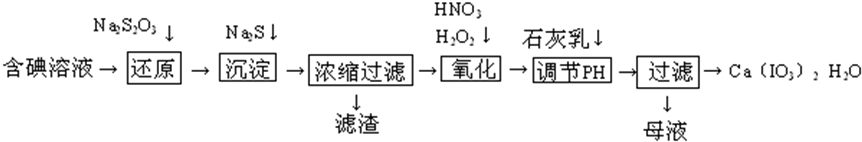
已知:①Ca(IO3)2微溶于水,可溶于硝酸; ②Ksp(CuI)=1.1×10-12,Ksp(Cu2S)=2.5×10-48;
③氧化性强弱顺序为:HNO3>IO3->H2O2.
(1)“还原”过程中发生的主要反应化学方程式为:2Na2S2O3+I2=Na2S4O6+2NaI,则此反应中每得到1mol的还原产物,转移的电子数目约为6.02×1023个.
(2)在还原过程通常伴随有CuI生成,此时再加入足量的Na2S的化学反应方程式2CuI+Na2S=Cu2S+2NaI_;充分反应后再过滤并将所得滤渣与足量的浓硝酸混合加热,此时反应的离子方程式为Cu2S+12H ++10NO3- $\frac{\underline{\;\;△\;\;}}{\;}$2Cu2++SO42-+10NO2↑+6H2O.
(3)在氧化过程中通常应先加入一定量的H2O2再加入少量的浓硝酸,而不直接加入足量的浓硝酸的目的是可以减少生成污染空气的氮的氧化物.
(4)加入的石灰乳在溶液中发生反应可得到Ca(IO3)2,此时需要调节溶液pH至中性而不是酸性或碱性的原因是在酸性溶液中,Ca(IO3)2部分溶解在硝酸;在碱性溶液中,可能会混有少量微溶的Ca(OH)2 造成产品不纯.
(5)Ca(IO3)2也可用电化学氧化法制取:先充分电解KI溶液,然后在电解后的溶液中加入一定量的CaCl2溶液,最后过滤得到Ca(IO3)2.写出电解时阳极发生的电极反应式3H2O+I--6e-=IO3-+6H+.
用该方法制取Ca(IO3)2,每1kg碘化钾理论上可生产纯度为88.8%Ca(IO3)2的质量为1.32 kg(计算结果保留3位有效数字).
分析 I2和CuSO4溶液中加入硫代硫酸钠还原生成Na2S4O6,同时有CuI生成,再加入硫化钠产生硫化亚铜沉淀,过滤后在滤液中加入双氧水和硝酸将碘离子氧化成碘酸根,再加石灰乳,过滤得Ca(IO3)2,滤液可以循环利用,
(1)在反应2Na2S2O3+I2=Na2S4O6+2NaI中,碘的化合价降低,所以NaI是还原产物,根据化合价的变化可以计算出转移电子数目;
(2)结合所给溶解度,利用沉淀转化原理书写;硝酸具有强氧化性,Cu2S中两种元素化合价都变,可将其作一整体,然后运用守恒的思想配平;
(3)依据双氧水具有氧化性,且其还原产物为绿色无污染回答;
(4)依据所给信息“Ca(IO3)2微溶于水,可溶于硝酸”回答即可;
(5)电解时,阴极上氢离子放电,阳极上碘离子放电;依据方程式计算碘酸钙的质量.
解答 解:I2和CuSO4溶液中加入硫代硫酸钠还原生成Na2S4O6,同时有CuI生成,再加入硫化钠产生硫化亚铜沉淀,过滤后在滤液中加入双氧水和硝酸将碘离子氧化成碘酸根,再加石灰乳,过滤得Ca(IO3)2,滤液可以循环利用,
(1)反在反应2Na2S2O3+I2=Na2S4O6+2NaI中,碘的化合价降低,所以NaI是还原产物,每生成1mol的NaI,转移的电子数目约为6.02×1023,
故答案为:6.02×1023;
(2)由于Ksp(CuI)=1.1×10-12,Ksp(Cu2S)=2.5×10-48,硫化亚铜比CuI更难溶,故加入足量的Na2S除去CuI的方程式为:2CuI+Na2S=Cu2S+2NaI,在Cu2S中:Cu和S元素化合价均升高,而HNO3中N+5→+2化合价降低3,根据化合价的升降守恒得:Cu2S+12H ++10NO3- $\frac{\underline{\;\;△\;\;}}{\;}$2Cu2++SO42-+10NO2↑+6H2O,
故答案为:2CuI+Na2S=Cu2S+2NaI; Cu2S+12H ++10NO3- $\frac{\underline{\;\;△\;\;}}{\;}$2Cu2++SO42-+10NO2↑+6H2O;
(3)浓硝酸的还原产物会对大气造成污染,双氧水也具有氧化性,且还原产物为水,无污染,
故答案为:可以减少生成污染空气的氮的氧化物;
(4)Ca(IO3)2微溶于水,可溶于硝酸,即在酸性溶液中,Ca(IO3)2部分溶解;在碱性溶液中,可能会混有少量微溶的Ca(OH)2 造成产品不纯,
故答案为:在酸性溶液中,Ca(IO3)2部分溶解在硝酸;在碱性溶液中,可能会混有少量微溶的Ca(OH)2 造成产品不纯;
(5)电解时,阴极上氢离子放电生成氢气,阳极上碘离子放电生成KIO3,电极反应为:I--6e-+3H2O=IO3-+6H+,每1kgKI理论上可生产纯度为88.8%Ca(IO3)2的质量设为x,可以依据元素守恒计算,
2KI~Ca(IO3)2
332 390
1kg x×88.8%
x=1.32kg,
故答案为:3H2O+I--6e-=IO3-+6H+; 1.32.
点评 本题主要以无机物的制备流程为载体,考查的是氧化还原反应方程式书写以及配平、电解原理的应用等,综合性较强,有一定难度.

 名校课堂系列答案
名校课堂系列答案
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)气体发生装置使用连通滴液漏斗的原因使连通滴液漏斗里的溶液容易滴下.
(3)请写出C装置中的离子反应方程式SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O.
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽.
(5)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷易凝结成固体而发生堵塞.
(6)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是乙醇挥发、副反应发生或反应太剧烈
(7)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,其原因是乙烯和液溴均易溶于四氯化碳.
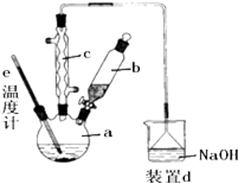 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶[来 | 微溶 |
①装置c为球形冷凝管,冷凝水的水流方向为下进上出(填“上进下出”或“下进上出”).
②写出在a中发生的化学反应方程式2Fe+3Br2=2FeBr3、、C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.
③装置d中NaOH溶液的作用是吸收HBr和Br2.
(2)液溴滴完后,经过下列步骤分离提纯:
Ⅰ向a中加入10mL水,然后过滤除去未反应的铁屑;
Ⅱ滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.
Ⅲ向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
回答下列问题:
①纯溴苯为无色油状液体,而a中得到的粗产品呈褐色,则粗产品中溶解的主要杂质是Br2(填化学式).
②用10%的NaOH溶液洗涤的目的是除去溴苯中溶解的杂质,该杂质为Br2(填化学式).
③加入氯化钙的目的是干燥.
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母).
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.

 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].