题目内容
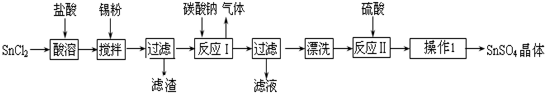
13.晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等.以下是工业上制取纯硅的一种方法.
请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有①②③(填反应代号).
(2)写出反应③的化学方程式SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl.
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂.将石英砂和纯碱按一定比例混合加热至1 373~1 623K反应,生成化合物W,其化学方程式是SiO2+Na2CO3$\frac{\underline{\;1373-1623K\;}}{\;}$Na2SiO3+CO2↑
(4)A、B、C三种气体在“节能减排”中作为减排目标的一种气体是CO2(填化学式);分别通入W溶液中能得到白色沉淀的气体是CO2和HCl(填化学式).
(5)工业上合成氨的原料H2的制法是先把焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为CO+H2O(g)$\frac{\underline{\;催化剂1073K\;}}{\;}$CO2+H2、CO2+Ca(OH)2═CaCO3↓+H2O.
分析 反应①为石英砂和焦炭生成粗硅和一氧化碳的反应:SiO2+2C$\frac{\underline{\;1373-1623K\;}}{\;}$Si+2CO↑,属于置换反应;反应②是Si+3HCl$\frac{\underline{\;523-527\;}}{\;}$SiHCl3+H2,属于置换反应;反应③是SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl,属于置换反应;反应④为特定条件下的反应:CO+H2O(g)$\frac{\underline{\;催化剂1073K\;}}{\;}$CO2+H2,不属于置换反应.A、B、C分别为CO、CO2、HCl,其中CO2是温室气体,是节能减排的目标气体,CO2和HCl通入W(硅酸钠)溶液中能够生成白色沉淀(硅酸).
(1)置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应;
(2)反应③是SiHCl3被氢气还原得到硅和氯化氢;
(3)二氧化硅与碳酸钠高温反应生成硅酸钠;
(4)A、B、C分别为CO、CO2、HCl,化合物W为硅酸钠;
(5)碳和水反应生成一氧化碳和氢气,一氧化碳和水反应生成二氧化碳和氢气,二氧化碳能和氢氧化钙反应生成碳酸钙.
解答 解:(1)置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,①②③属于置换反应,故答案为:①②③;
(2)反应③是SiHCl3被氢气还原得到硅和氯化氢,反应的化学方程式为SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl,故答案为:SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl;
(3)二氧化硅与碳酸钠高温反应生成硅酸钠,反应方程式为SiO2+Na2CO3$\frac{\underline{\;1373-1623K\;}}{\;}$Na2SiO3+CO2↑,故答案为:SiO2+Na2CO3$\frac{\underline{\;1373-1623K\;}}{\;}$Na2SiO3+CO2↑;
(4)A、B、C分别为CO、CO2、HCl,作为减排目标的一种气体是CO2,化合物W为硅酸钠,能与W反应生成沉淀的是CO2和HCl,
故答案为:CO2;CO2和HCl;
(5)碳和水反应生成一氧化碳和氢气:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2,一氧化碳和水反应生成二氧化碳和氢气:CO+H2O(g)$\frac{\underline{\;催化剂1073K\;}}{\;}$CO2+H2,二氧化碳能和氢氧化钙反应生成碳酸钙:CO2+Ca(OH)2═CaCO3↓+H2O,
故答案为:CO+H2O(g)$\frac{\underline{\;催化剂1073K\;}}{\;}$CO2+H2、CO2+Ca(OH)2═CaCO3↓+H2O.
点评 本题考查无机物的推断,主要是物质转化关系,物质制备流程分析判断,明确各物质的成分是解题的关键,题目难度中等.

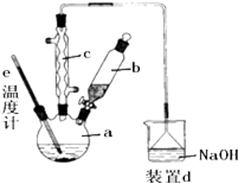 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶[来 | 微溶 |
①装置c为球形冷凝管,冷凝水的水流方向为下进上出(填“上进下出”或“下进上出”).
②写出在a中发生的化学反应方程式2Fe+3Br2=2FeBr3、、C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.
③装置d中NaOH溶液的作用是吸收HBr和Br2.
(2)液溴滴完后,经过下列步骤分离提纯:
Ⅰ向a中加入10mL水,然后过滤除去未反应的铁屑;
Ⅱ滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.
Ⅲ向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
回答下列问题:
①纯溴苯为无色油状液体,而a中得到的粗产品呈褐色,则粗产品中溶解的主要杂质是Br2(填化学式).
②用10%的NaOH溶液洗涤的目的是除去溴苯中溶解的杂质,该杂质为Br2(填化学式).
③加入氯化钙的目的是干燥.
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母).
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.