题目内容
16.某无色气体可能是H2S,H2,O2,Cl2,NO,NO2,NH3,SO2,CO2中的一种或几种,做实验如下:①若此混合气体通过P2O5无变化,通过浓硫酸有混浊现象,但体积不缩小,剩余气体通过碱石灰,则气体体积缩小到原来的20%,残余气体能燃烧.②若此混合气体通过灼热的铜网,铜网表面变黑,但恢复到原来的温度和压强,体积无变化.③若此混合气体通过装有湿润的有色布条试剂瓶,发现布条不褪色,打开瓶盖也无颜色变化,④若此混合气体通过热的CuSO4溶液时,剩余气体体积为原来的60%,据以上事实,下列说法正确的是( )| A. | 实验①中通过浓硫酸后气体成分为CO2,H2 | |
| B. | 混合气体中一定含有H2S,H2,CO2,可能有O2 | |
| C. | ②中化学方程式可表示H2S+Cu═CuS+H2 | |
| D. | 把混合气充入轻质气体,待密封好松开手,气球不能自行升空 |
分析 某无色气体可能是H2S,H2,O2,Cl2,NO,NO2,NH3,SO2,CO2中的一种或几,确定一定不含黄绿色气体Cl2、红棕色气体NO2,
①若此混合气体通过P2O5无变化,证明气体中无NH3,通过浓硫酸有混浊现象,但体积不缩小,判断存在H2S气体,依据气体不能共存分析一定不含有SO2,
剩余气体通过碱石灰,则气体体积缩小到原来的20%,残余气体能燃烧,可能含有CO2、H2,则H2占$\frac{1}{5}$,
②若此混合气体通过灼热的铜网,铜网表面变黑,但恢复到原来的温度和压强,体积无变化,2Cu+O2=2CuO,反应前后气体体积变化,所以证明不含有O2,是H2S和铜发生的反应;
③若此混合气体通过装有湿润的有色布条试剂瓶,发现布条不褪色,打开瓶盖也无颜色变化,判断原气体中一定不含有NO,
④若此混合气体通过热的CuSO4溶液时,剩余气体体积为原来的60%,则H2S占$\frac{2}{5}$,计算得到CO2占$\frac{2}{5}$,
上述分析可知原气体中一定不存在Cl2、NO2、NH3、SO2、O2,一定存在CO2、H2、H2S,据此分析选项;
A、实验①中通过浓硫酸后,硫化氢和浓硫酸发生氧化还原反应生成SO2;
B、混合气体中不含O2;
C、反应是在加热条件下发生的反应;
D、计算混合物气体平均摩尔质量和空气平均摩尔质量比较判断气球是否上升.
解答 解:A、实验①中通过浓硫酸后,硫化氢和浓硫酸发生氧化还原反应生成SO2,实验①中通过浓硫酸后气体成分为SO2、CO2,H2 ,故A错误;
B、上述分析可知,混合气体中一定含有H2S,H2,CO2,混合气体中不含O2,故B错误
C、反应是在加热条件下发生的反应,②中化学方程式可表示H2S+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuS+H2,故C错误;
D、混合气体中一定含有H2S,H2,CO2,分别为H2S占$\frac{2}{5}$,H2占$\frac{1}{5}$,CO2占$\frac{2}{5}$,气体品均摩尔质量=$\frac{\frac{2}{5}×34+\frac{1}{5}×2+\frac{2}{5}×44}{1}$=31.6g/mol>空气平均摩尔质量29g/mol,气球不能自行升空,故D正确;
故选D.
点评 本题考查了气体组成、性质和反应现象分析,反应前后气体体积的变化计算,注意气体反应和生成气体的理解应用,掌握基础是解题关键,题目难度较大.

| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O | |
| B. | CuSO4溶液与过量浓氨水反应的离子方程式:Cu2++2NH3-H2O=Cu(OH)2↓+2NH4+ | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2 H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ |
| A. | 向溶Ca(ClO)2液中通入少量SO2:Ca2++3ClO-+SO2 +H2O═CaSO4 ↓+Cl-+2HClO | |
| B. | 1mol/L的NaAlO2 溶液和2.5mol/L的盐酸等体积均匀混合:2AlO2-+5H+═A l(OH)3 ↓+Al3++H2O | |
| C. | 将11.2L标准状况下的氯气通入200mL 2mol/LFeBr2 的溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2 ═2Fe3++4Br2 +10Cl- | |
| D. | 氢氧化亚铁溶于稀硝酸中:Fe(OH)2 +2H+═Fe2++H2O |
 (其中之一);.
(其中之一);. 或
或 或
或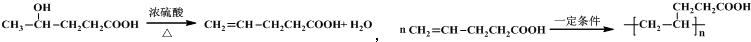 .
.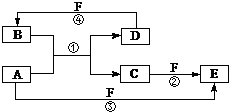 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出). ;反应④的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
;反应④的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O. ,反应①的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
,反应①的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时刻达到平衡,如图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时刻达到平衡,如图所示: