题目内容
8.下列离子反应方程式正确的是( )| A. | 向溶Ca(ClO)2液中通入少量SO2:Ca2++3ClO-+SO2 +H2O═CaSO4 ↓+Cl-+2HClO | |
| B. | 1mol/L的NaAlO2 溶液和2.5mol/L的盐酸等体积均匀混合:2AlO2-+5H+═A l(OH)3 ↓+Al3++H2O | |
| C. | 将11.2L标准状况下的氯气通入200mL 2mol/LFeBr2 的溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2 ═2Fe3++4Br2 +10Cl- | |
| D. | 氢氧化亚铁溶于稀硝酸中:Fe(OH)2 +2H+═Fe2++H2O |
分析 A.少量SO2通入Ca(ClO)2溶液中,发生氧化还原反应生成硫酸钙;
B.计算出偏铝酸钠和氯化氢的物质的量,然后根据过量情况判断反应产物;
C.还原性Fe2+>Br-,所以通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-;
D.稀硝酸具有强氧化性,能够将亚铁离子氧化成铁离子.
解答 解:A.少量SO2通入Ca(ClO)2溶液中,二者发生氧化还原反应,正确的离子反应为:SO2+Ca2++3ClO-+H2O=CaSO4↓+2HClO+Cl-,故A错误;
B.AlO2-与H+按物质的量1:1反应转化为Al(OH)3,过量的H+再将一半Al(OH)3转化为Al3+,反应的离子方程式为:2AlO2-+5H+═Al3++Al(OH)3↓+H2O,故B正确;
C.还原性Fe2+>Br-,所以通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-,200mL 2mol/L的FeBr2溶液中0.4molFeBr2,含有0.4mol亚铁离子和0.8mol溴离子,通入11.2L标准状况下的Cl2物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,0.4mol亚铁离子完全反应消耗0.2mol氯气,剩余的0.3mol氯气完全反应消耗0.6mol溴离子,则常见反应的亚铁离子与溴离子的物质的量之比为0.4mol:0.6mol=2:3,则反应的离子方程式为:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl-,故C错误;
D.氢氧化亚铁和稀硝酸发生氧化还原反应生成铁离子、NO和水,正确的离子方程式为:3Fe(OH)2+NO3-+10H+=3Fe3++NO↑+8H2O,故D错误;
故选B.
点评 本题考查离子方程式正误判断,题目难度中等,涉及氧化还原反应、离子反应,注意反应物的量对产物的影响,注意D中硝酸的强氧化性、C中离子还原性强弱顺序,为易错点.

| A. | 氢氧化铁 | B. | 金属铝 | C. | 氧化铝 | D. | 硫酸铜 |
| A. | 氢氧化铝和碳酸氢钠都可以作为治疗胃酸过多的药剂 | |
| B. | 血液透析是利用了胶体的性质 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 碘是人体必需微量元素,所以要多吃富含碘单质的食物 |
| A. | 实验①中通过浓硫酸后气体成分为CO2,H2 | |
| B. | 混合气体中一定含有H2S,H2,CO2,可能有O2 | |
| C. | ②中化学方程式可表示H2S+Cu═CuS+H2 | |
| D. | 把混合气充入轻质气体,待密封好松开手,气球不能自行升空 |

| A. | M的氧化物易溶于水 | |
| B. | 碳的最简单氢化物的稳定性强于A的 | |
| C. | 钾和B组成的化合物的水溶液显碱性 | |
| D. | A、B形成的化合物中可能含有离子键 |
(1)CuFeS2中的Fe的化合价为+2,则被氧化的元素为Fe和CuFeS2中的S(填元素名称)
(2)工业生产中利用上述反应后的溶液,按如下流程可制备胆矾(CuSO4•5H2O):
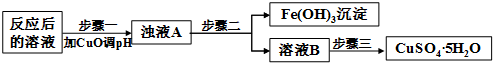
①分析下列表格(其中Ksp是相应金属氢氧化物的沉淀溶解平衡常数):
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
②步骤三中的具体操作方法是蒸发浓缩,冷却结晶
(3)工业上冶炼铜的方法之一为:
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g)△H
已知:①2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-12kJ/mol
②2Cu(s)+S(s)=Cu2S(s)△H=-79.5kJ/mol
③S(s)+O2(g)=SO2(g)△H=-296.8kJ/mol
则该法冶炼铜的反应中△H=-193.3kJ•mol-1.
| A. | m=3 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | X与Y的平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为原平衡的2倍 |