题目内容
4.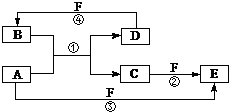 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).请回答下列问题:
(1)若A为第三周期的金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,F的浓溶液与A、D反应都有红棕气体生成,则A的原子结构示意图为
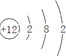 ;反应④的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
;反应④的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.(2)若A为用量最大的金属,D、F是气态单质,反应②的离子方程式是:Cl2+2Fe2+=2Cl-+2Fe3+,A与水蒸气反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2.
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,B常用作光导纤维,A、F所含元素同周期,则E的电子式为
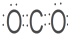 ,反应①的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
,反应①的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
分析 (1)若A为第三周期的金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,则A原子序数是偶数,所含元素的原子最外层电子数D是A的2倍,则A是Mg、D是C元素,F的浓溶液与A、D反应都有红棕色气体生成,红棕色气体是NO2,则F是HNO3,C和HNO3浓溶液反应生成CO2、NO2和H2O,B能和Mg反应生成碳单质,则B是CO2,C是MgO,MgO和硝酸反应生成Mg(NO3)2和H2O,Mg和硝酸反应生成Mg(NO3)2,则E是Mg(NO3)2;
(2)若A为用量最大的金属,则A是Fe,D、F是气态单质,反应①在水溶液中进行.反应②也在水溶液中进行,则B是酸,C是盐,D和F反应生成酸,盐和气体单质F反应生成E,Fe和气体单质直接反应生成E,则F是Cl2、E是FeCl3、C是FeCl2、B是HCl、D是H2;
(3)A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,B常用作光导纤维,则B为SiO2,A、F所含元素同周期,则A为C,D为Si,F为O2,根据转化关系,C为CO,E为CO2,反应①为C与二氧化硅的反应,据此答题.
解答 解:(1)若A为第三周期的金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,则A原子序数是偶数,所含元素的原子最外层电子数D是A的2倍,则A是Mg、D是C元素,F的浓溶液与A、D反应都有红棕色气体生成,红棕色气体是NO2,则F是HNO3,C和HNO3浓溶液反应生成CO2、NO2和H2O,B能和Mg反应生成碳单质,则B是CO2,C是MgO,MgO和硝酸反应生成Mg(NO3)2和H2O,Mg和硝酸反应生成Mg(NO3)2,则E是Mg(NO3)2;
通过以上分析知,A是Mg,A的原子结构示意图为 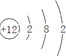 ;反应④的化学方程式为在加热条件下,碳和浓硝酸发生氧化还原反应生成二氧化碳、二氧化氮和水,反应方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O,
;反应④的化学方程式为在加热条件下,碳和浓硝酸发生氧化还原反应生成二氧化碳、二氧化氮和水,反应方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O,
故答案为: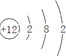 ;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O;
;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O;
(2)若A为用量最大的金属,则A是Fe,D、F是气态单质,反应①在水溶液中进行.反应②也在水溶液中进行,则B是酸,C是盐,D和F反应生成酸,盐和气体单质F反应生成E,Fe和气体单质直接反应生成E,则F是Cl2、E是FeCl3、C是FeCl2、B是HCl、D是H2,氯化亚铁被氯气氧化生成氯化铁,离子反应方程式为:Cl2+2Fe2+=2Cl-+2Fe3+,铁与水蒸汽反应的方程式为 3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,
故答案为:Cl2+2Fe2+=2Cl-+2Fe3+; 3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;
(3)A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,B常用作光导纤维,则B为SiO2,A、F所含元素同周期,则A为C,D为Si,F为O2,根据转化关系,C为CO,E为CO2,E的电子式为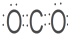 ,反应①为C与二氧化硅的反应,该反应为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
,反应①为C与二氧化硅的反应,该反应为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为: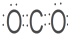 ;2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
;2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
点评 本题考查无机物的推断、常用化学用语等,为高频考点,涉及常见元素及其化合物知识的考查,把握元素的位置及单质的性质来分析推断各物质,注意根据物质的特殊元素、物质结构、物质之间的转化关系进行推断,熟悉常见单质及其化合物的性质是解本题关键,题目难度中等.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案| 选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| D | 取1mL20%的蔗糖溶液,加入3~5滴稀硫酸,水浴加热5min后,直接加入少量新制备的Cu(OH)2,加热3~5min,没有产生砖红色沉淀 | 说明蔗糖没有水解. |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
| A. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 | |
| C. | 要将溶解在CCl4中的碘单质分离出来,可以用蒸馏法,因为碘易升华,先分离出来 | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
| A. | 氢氧化铝和碳酸氢钠都可以作为治疗胃酸过多的药剂 | |
| B. | 血液透析是利用了胶体的性质 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 碘是人体必需微量元素,所以要多吃富含碘单质的食物 |
| A. | CO${\;}_{3}^{2-}$ | B. | Al3+ | C. | Cu2+ | D. | OH- |
| A. | 实验①中通过浓硫酸后气体成分为CO2,H2 | |
| B. | 混合气体中一定含有H2S,H2,CO2,可能有O2 | |
| C. | ②中化学方程式可表示H2S+Cu═CuS+H2 | |
| D. | 把混合气充入轻质气体,待密封好松开手,气球不能自行升空 |

| A. | M的氧化物易溶于水 | |
| B. | 碳的最简单氢化物的稳定性强于A的 | |
| C. | 钾和B组成的化合物的水溶液显碱性 | |
| D. | A、B形成的化合物中可能含有离子键 |
| A. | 2min时,c(SO2)=0.6mol•L-1 | |
| B. | 再向容器中充入1mol SO3,达到新平衡,n(SO2):n(SO3)=2:1 | |
| C. | 用O2表示4min内的反应速率为0.1mol•(L•min)-1 | |
| D. | 4min后,若升高温度,平衡向逆方向移动,平衡常数K增大 |