题目内容
1.溴主要用于制造汽油抗爆剂、感光材料、医药、试剂和农药等.工业上利用制盐后的卤水提取溴,这种卤水含溴离子的浓度很低,在生产中用下列方法制取液溴.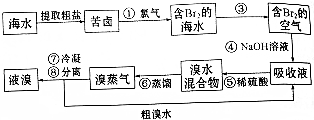
回答下列问题.
(1)吸收液中的主要成分是NaBr、NaBrO3和H2O,请写出过程④的化学方程式:6NaOH+3Br2=5NaBr+NaBrO3+3H2O;
(2)溴化钠是实验室常用试剂,用化学方程式表示如何检验溴化钠中的溴离子:NaBr+AgNO3=AgBr↓+NaNO3;
(3)步骤③一般采用的方法是通入热空气或水蒸气把溴从溶液中把溴单质从溶液中挥发出来;
(4)第⑧步分离的目的是除去溴中混有的少量氯气和水,要除去少量的氯气,采用的试剂是NaBr,然后操作名称是分液.
分析 海水晒盐后得到粗盐和母液苦卤,苦卤中加入氯气氧化溴离子得到溴单质的低浓度溶液,加入氢氧钠溶液吸收溴单质,得到吸收液为NaBr、NaBrO3和H2O,再加入稀硫酸,发生归中反应得到高浓度的溴单质溶液,蒸馏得到溴蒸气冷凝分离得到液溴,粗溴水到吸收液中重新利用;
(1)氢氧化钠和溴单质反应生成NaBr、NaBrO3和H2O;
(2)检验溴离子是利用溴离子和硝酸银反应得到淡黄色沉淀溴化银设计检验;
(3)步骤③得到的是含Br2的空气,是利用溴单质易挥发,用热空气吹出;
(4)除去溴中混有的少量氯气和水,要除去少量的氯气需要加入溴化钠发生氧化还原反应,然后用分液的方法得到液溴.
解答 解:(1)氢氧化钠和溴单质反应生成NaBr、NaBrO3和H2O,反应的化学方程式为:6NaOH+3Br2=5NaBr+NaBrO3+3H2O,
故答案为:6NaOH+3Br2=5NaBr+NaBrO3+3H2O;
(2)检验溴离子是利用溴离子和硝酸银反应得到淡黄色沉淀溴化银设计检验,反应的化学方程式为NaBr+AgNO3=AgBr↓+NaNO3,
故答案为:NaBr+AgNO3=AgBr↓+NaNO3;
(3)步骤③得到的是含Br2的空气,是利用溴单质易挥发,用热空气吹出,采用的方法是:通入热空气或水蒸气把溴从溶液中把溴单质从溶液中挥发出来,
故答案为:通入热空气或水蒸气把溴从溶液中把溴单质从溶液中挥发出来;
(4)除去溴中混有的少量氯气和水,要除去少量的氯气需要加入溴化钠发生氧化还原反应,2NaBr+Cl2=2NaCl+Br2,然后用分液的方法得到液溴,
故答案为:NaBr;分液.
点评 本题考查了海水中溴的制备流程和过程分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
11. 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的实验现象正确的是( )
实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的实验现象正确的是( )
①装有铜片的孔穴中溶液呈蓝色;②装有胆矾的孔穴中固体的颜色变浅;③装有铝片的孔穴中有红棕色气体生成;④装有蛋清溶液的孔穴中呈浅黄色.
 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的实验现象正确的是( )
实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的实验现象正确的是( )①装有铜片的孔穴中溶液呈蓝色;②装有胆矾的孔穴中固体的颜色变浅;③装有铝片的孔穴中有红棕色气体生成;④装有蛋清溶液的孔穴中呈浅黄色.
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ①② |
12.下列说法正确的是( )
| A. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 | |
| C. | 要将溶解在CCl4中的碘单质分离出来,可以用蒸馏法,因为碘易升华,先分离出来 | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
9.某无色溶液中存在大量NH${\;}_{4}^{+}$、H+、Cl-,还可能大量存在的离子是( )
| A. | CO${\;}_{3}^{2-}$ | B. | Al3+ | C. | Cu2+ | D. | OH- |
16.某无色气体可能是H2S,H2,O2,Cl2,NO,NO2,NH3,SO2,CO2中的一种或几种,做实验如下:①若此混合气体通过P2O5无变化,通过浓硫酸有混浊现象,但体积不缩小,剩余气体通过碱石灰,则气体体积缩小到原来的20%,残余气体能燃烧.②若此混合气体通过灼热的铜网,铜网表面变黑,但恢复到原来的温度和压强,体积无变化.③若此混合气体通过装有湿润的有色布条试剂瓶,发现布条不褪色,打开瓶盖也无颜色变化,④若此混合气体通过热的CuSO4溶液时,剩余气体体积为原来的60%,据以上事实,下列说法正确的是( )
| A. | 实验①中通过浓硫酸后气体成分为CO2,H2 | |
| B. | 混合气体中一定含有H2S,H2,CO2,可能有O2 | |
| C. | ②中化学方程式可表示H2S+Cu═CuS+H2 | |
| D. | 把混合气充入轻质气体,待密封好松开手,气球不能自行升空 |
13.元素周期表有多种形式.如图是一种三角形元素素周期表的一部分,下列说法正确的是( )

| A. | M的氧化物易溶于水 | |
| B. | 碳的最简单氢化物的稳定性强于A的 | |
| C. | 钾和B组成的化合物的水溶液显碱性 | |
| D. | A、B形成的化合物中可能含有离子键 |
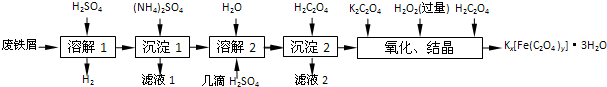
3.草酸合铁酸钾晶体Kx[Fe(C2O4)y]•3H2O是一种光敏材料,下面是一种制备草酸合铁酸钾晶体的实验流程.
已知:(NH4)2SO4、FeSO4•7H2O、莫尔盐[(NH4)2SO4•FeSO4•6H2O]的溶解度如下表:
(1)“溶解1”应保证铁屑稍过量,其目的是防止Fe2+被氧化为Fe3+.“溶解2”加“几滴H2SO4”的作用是抑制Fe2+水解.
(2)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是洗去杂质,减少莫尔盐晶体溶解损失,便于快速干燥.
(3)“沉淀”时得到的FeC2O4•2H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净.
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是黑暗可以防止晶体分解.
(5)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4酸化,加入足量KMnO4溶液,C2O42-转化为CO2被除去.
步骤3:向步骤2所得溶液中加入稍过量的锌粉加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中.
步骤4:用c mol•L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.

已知:(NH4)2SO4、FeSO4•7H2O、莫尔盐[(NH4)2SO4•FeSO4•6H2O]的溶解度如下表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4•7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4•FeSO4•6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(2)“复分解”制备莫尔盐晶体的基本实验步骤是:蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、干燥.用乙醇洗涤的目的是洗去杂质,减少莫尔盐晶体溶解损失,便于快速干燥.
(3)“沉淀”时得到的FeC2O4•2H2O沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净.
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是黑暗可以防止晶体分解.
(5)请补全测定草酸合铁酸钾产品中Fe3+含量的实验步骤【备选试剂:KMnO4溶液、锌粉、铁粉、NaOH溶液】:
步骤1:准确称取所制备的草酸合铁酸钾晶体a g,配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入稀H2SO4酸化,加入足量KMnO4溶液,C2O42-转化为CO2被除去.
步骤3:向步骤2所得溶液中加入稍过量的锌粉加热至充分反应(溶液黄色刚好消失),过滤、洗涤、将过滤及洗涤所得溶液收集到锥形瓶中.
步骤4:用c mol•L-1 KMnO4标准溶液滴定步骤3所得溶液至终点,消耗V mL KMnO4标准溶液.
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签如图,则该注射液中葡萄糖的质量分数为5%物质的量浓度为0.28 mol/L.
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签如图,则该注射液中葡萄糖的质量分数为5%物质的量浓度为0.28 mol/L.