题目内容
19. 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时刻达到平衡,如图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时刻达到平衡,如图所示:(1)该反应的化学方程式是2X?3Y+Z.
(2)反应起始至t1,Y的平均反应速率是$\frac{0.6}{{t}_{1}}$mol/(L﹒min).
(3)下列条件的改变一定能使化学反应加快的是B.
A.增加X的物质的量 B.升高体系的温度
C.减少Z的物质的量 D.增加体系的压强.
分析 (1)由图象可以看出,反应中X的物质的量减小,Y、Z的物质的量增多,则X为反应物,Y、Z为生成物.t时刻后,X的物质的量为定值且不为零,为可逆反应,化学化学计量数之比等于物质的量变化量之比;
(2)根据v=$\frac{△c}{△t}$计算v(Y);
(3)A.X若为固体或纯液态,增大X的物质的量,不影响反应速率;
B.升高体系的温度,反应速率一定加快;
C.减少Z的物质的量,若为生成物为气体,反应速率会减低,X若为固体或纯液态,不影响反应速率;
D.增加体系的压强,若没有气体参与,不影响反应速率.
解答 解:(1)由图象可以看出,反应中X的物质的量减小,Y、Z的物质的量增多,则X为反应物,Y、Z为生成物.t时刻后,X的物质的量为定值且不为零,为可逆反应,且△n(X):△n(Y):△n(Z)=0.8mol:1.2mol:0.4mol=2:3:1,则反应的化学方程式为:2X?3Y+Z,
故答案为:2X?3Y+Z;
(2)反应起始至t1,Y的平均反应速率v(Y)=$\frac{\frac{1.2mol}{2L}}{{t}_{1}min}$=$\frac{0.6}{{t}_{1}}$mol/(L﹒min),
故答案为:$\frac{0.6}{{t}_{1}}$mol/(L﹒min);
(3)A.若X为气体,增加X的物质的量,反应速率加快,X若为固体或纯液态,增大X的物质的量,不影响反应速率,故A错误;
B.升高体系的温度,反应速率一定加快,故B正确;
C.减少Z的物质的量,若为生成物为气体,反应速率会减低,X若为固体或纯液态,不影响反应速率,故C错误;
D.增加体系的压强,若没有气体参与,不影响反应速率,若有气体参加,反应速率加快,故D错误,
故选:B.
点评 本题考查化学平衡计算、反应速率计算与影响因素,题目难度不大,注意相关知识的积累,熟练掌握外界条件对化学反应速率的影响.

| A. | 实验①中通过浓硫酸后气体成分为CO2,H2 | |
| B. | 混合气体中一定含有H2S,H2,CO2,可能有O2 | |
| C. | ②中化学方程式可表示H2S+Cu═CuS+H2 | |
| D. | 把混合气充入轻质气体,待密封好松开手,气球不能自行升空 |
(1)CuFeS2中的Fe的化合价为+2,则被氧化的元素为Fe和CuFeS2中的S(填元素名称)
(2)工业生产中利用上述反应后的溶液,按如下流程可制备胆矾(CuSO4•5H2O):
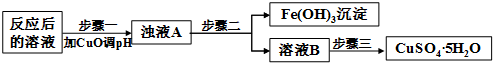
①分析下列表格(其中Ksp是相应金属氢氧化物的沉淀溶解平衡常数):
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
②步骤三中的具体操作方法是蒸发浓缩,冷却结晶
(3)工业上冶炼铜的方法之一为:
Cu2S(s)+2Cu2O(s)=6Cu(s)+SO2(g)△H
已知:①2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-12kJ/mol
②2Cu(s)+S(s)=Cu2S(s)△H=-79.5kJ/mol
③S(s)+O2(g)=SO2(g)△H=-296.8kJ/mol
则该法冶炼铜的反应中△H=-193.3kJ•mol-1.
| A. | 2min时,c(SO2)=0.6mol•L-1 | |
| B. | 再向容器中充入1mol SO3,达到新平衡,n(SO2):n(SO3)=2:1 | |
| C. | 用O2表示4min内的反应速率为0.1mol•(L•min)-1 | |
| D. | 4min后,若升高温度,平衡向逆方向移动,平衡常数K增大 |

| A. | 稀盐酸 | B. | 稀硫酸 | C. | 氯化铁溶液 | D. | 碳酸钠溶液 |
| A. | m=3 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | X与Y的平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为原平衡的2倍 |
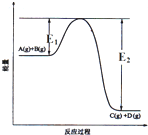 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,正确的是( )
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,正确的是( )| A. | 该反应是吸热反应 | |
| B. | 当反应达到平衡时,升高温度,A的转化率增大 | |
| C. | 反应体系中加入催化剂对反应热没有影响 | |
| D. | 在反应体系中加催化剂,反应速率增大,E1、E2均减小 |