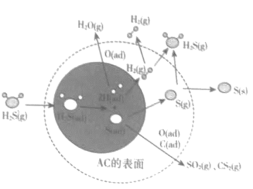
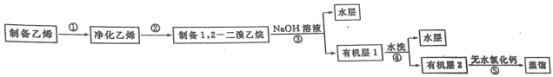
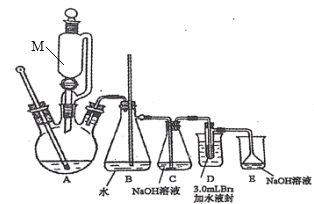
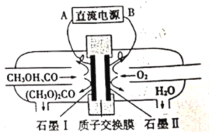
题目内容
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2 ) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a__1×10-14(填“>”、“<”或“=”),作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后溶液中c(Na+):c(OH-)=___。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V2:V1=___。
(5)t2℃下,取相同体积、相同pH的醋酸和盐酸,各稀释100倍后其pH大小关系为:pH(醋酸)___pH(盐酸)(填“大于”、“小于”或“等于”。下同);稀释后溶液分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(醋酸)___V(盐酸)。
【答案】> 温度升高,水的电离程度增大,离子积增加 c(OH-):c(Na+)=1︰100 1×10-10mol/L 11︰9 小于 大于
【解析】
(1)水是弱电解质,存在电离平衡,电离过程吸热,温度升高,水的电离程度增大,导致水的离子积增大,所以a>1×10-14;
(2)硫酸钠溶液中一定满足c(Na+):c(SO42- )=2:1;硫酸钠溶液中c(Na+)=2×5×10-4 molL-1=10-3,稀释后c(Na+)=![]() =10-5 molL-1,溶液呈中性,c(OH-)=1×10-7molL-1,c(Na+):c(OH-)=1×10-5molL-1:1×10-7molL-1=100:1;
=10-5 molL-1,溶液呈中性,c(OH-)=1×10-7molL-1,c(Na+):c(OH-)=1×10-5molL-1:1×10-7molL-1=100:1;
(3)pH=2的硫酸中c(H+)=10-2mol/L,根据图表可知t2℃下,Kw=1×10-12,c(OH-)=![]() mol/L=1×10-10mol/L,硫酸抑制水的电离,所以由水电离出的氢离子浓度是1×10-10mol/L;
mol/L=1×10-10mol/L,硫酸抑制水的电离,所以由水电离出的氢离子浓度是1×10-10mol/L;
(4)混合液的pH=2,酸过量,则c(H+)=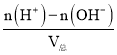 =
=![]() =0.01mol/L,整理可得V1:V2=9:11;
=0.01mol/L,整理可得V1:V2=9:11;
(5)相同条件下,取等体积、等pH的醋酸、盐酸两溶液,各稀释100倍,稀释过程中,醋酸继续电离出氢离子,导致稀释后的醋酸溶液中氢离子浓度大于盐酸,所以其pH大小关系为:pH(醋酸)小于pH(盐酸);稀释后溶液分别用等浓度的NaOH稀溶液中和至pH=7,因醋酸溶液中能发生中和反应的H+的物质的量远大于盐酸中的H+的物质的量,则消耗的NaOH溶液的体积大小关系为:V(醋酸)大于V(盐酸)。