题目内容
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为___。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=﹣196.6kJ·mol-1
2SO3(g) ΔH1=﹣196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH2=﹣113.0kJ·mol-1
2NO2(g) ΔH2=﹣113.0kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=___kJ·mol-1。
SO3(g)+NO(g)的ΔH=___kJ·mol-1。
(3)一定条件下,将2molNO2与2molSO2置于容积固定的恒温密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___(填字母)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
该反应达平衡状态后,若再向该容器充入1molNO2与1molSO2,则SO2的转化率将___(填“增大”“减小”或“不变”)
(4)已知N2O4(g)![]() 2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是___。
2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是___。
A.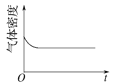 B.
B.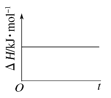 C.
C.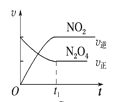 D.
D.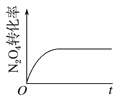
【答案】3NO2+H2O=2HNO3+NO 6.72 -41.8 b 不变 B
【解析】
(1)二氧化氮与水反应生成硝酸与NO;根据转移电子、结合N元素化合价变化计算消耗的NO2的物质的量,再根据V=nVm计算消耗NO2的体积;
(2)根据盖斯定律计算;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断;该反应达平衡状态后,若再向该容器充入1molNO2与1molSO2,则相当于缩小容器的体积,平衡向气体总物质的量减小的方向移动;
(4)化学反应平衡的判断可从以下几方面考虑:体系中所有反应物和生成物的质量(或浓度)保持不变,正反应速率等于逆反应速率。
(1)二氧化氮与水反应生成硝酸与NO,反应方程式为:3NO2+H2O=NO+2HNO3;当转移1.2mol电子时,消耗的NO2物质的量为![]() =0.3mol,消耗NO2的体积为0.3mol×22.4L/mol=6.72L;
=0.3mol,消耗NO2的体积为0.3mol×22.4L/mol=6.72L;
(2)已知:①2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1,②2NO(g)+O2(g)2NO2(g)△H=-113.0kJmol-1,根据盖斯定律,(①-②)÷2可得:NO2(g)+SO2(g)SO3(g)+NO(g),则△H=[-196.6kJmol-1-(-113.0kJmol-1)]÷2=-41.8kJmol-1;
(3)a.混合气体的总质量和总体积始终不变,则混合气体的密度也始终保持不变,不能说明反应达到平衡状态,故a错误;
b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;
c.伴随反应的进行SO3和NO的体积比始终保持不变,不能说明反应达到平衡状态,故c错误;
d.每消耗1mol SO3的同时生成1molNO2,均表示逆反应速率,不能判断是否达到平衡状态,故d错误;故答案为b;
该反应达平衡状态后,若再向该容器充入1molNO2与1molSO2,则相当于缩小容器的体积,对反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)而言,平衡不移动,SO2的转化率将不变。
SO3(g)+NO(g)而言,平衡不移动,SO2的转化率将不变。
(4)对于N2O4(g)2NO2(g),反应后体积变大;
A.密度不变,说明体积不变,选项A能说明达到平衡状态,故A正确;
B.△H=E生-E反,△H不随时间的变化,但会随着化学计量数的变化而变化,不能说明达到平衡状态,故B错误;
C.速率之比等于化学方程式计量数之比,图中表示v(NO2)逆=2v(N2O4)正,说明正逆反应速率相等,能说明达到平衡状态,故C正确;
D.N2O4的转化率不变,是平衡标志,说明了化学反应达到平衡状态,故D正确;
故答案为B。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2 ) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a__1×10-14(填“>”、“<”或“=”),作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后溶液中c(Na+):c(OH-)=___。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V2:V1=___。
(5)t2℃下,取相同体积、相同pH的醋酸和盐酸,各稀释100倍后其pH大小关系为:pH(醋酸)___pH(盐酸)(填“大于”、“小于”或“等于”。下同);稀释后溶液分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(醋酸)___V(盐酸)。





