题目内容
【题目】碳酸二甲酯[(CH3O)2CO]是一种具有发展前景的“绿色”化工产品。电化学法合成碳酸二甲酯的工作原理如图所示。下列说法错误的是
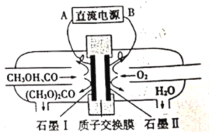
A.石墨I与直流电源正极相连
B.H+由石墨II通过质子交换膜向石墨I移动
C.石墨I上发生的电极反应为2CH3OH+CO-2e-=(CH3O)2CO+2H+
D.电解过程中,阴极和阳极消耗气体的物质的量之比为1:2
【答案】B
【解析】
该装置有外接电源,是电解池,由图可知甲醇和一氧化碳失电子发生氧化反应生成碳酸二甲酯,则电极石墨I为阳极,阳极反应为2CH3OH+CO-2e-═(CH3O)2CO+2H+,电极石墨II为阴极,阳极产生的氢离子从质子交换通过移向阴极,氧气在阴极得电子与氢离子反应生成水,电极反应为O2+4e-+4H+=2H2O,据此解答。
A.石墨I为阳极,与直流电源正极相连,故A正确;
B.电解池工作时,阳离子向阴极移动,即H+由石墨I通过质子交换膜向石墨II移动,故B错误;
C.石墨I为阳极,阳极上是甲醇和一氧化碳反应失电子发生氧化反应,电极反应为2CH3OH+CO-2e-=(CH3O)2CO+2H+,故C正确;
D.常温常压下甲醇是液体,电解池工作时转移电子守恒,根据关系式2CO~4e-~O2可知阴极消耗的氧气与阳极消耗的一氧化碳物质的量之比为1:2,故D正确;
故答案为B。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2 ) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a__1×10-14(填“>”、“<”或“=”),作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后溶液中c(Na+):c(OH-)=___。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V2:V1=___。
(5)t2℃下,取相同体积、相同pH的醋酸和盐酸,各稀释100倍后其pH大小关系为:pH(醋酸)___pH(盐酸)(填“大于”、“小于”或“等于”。下同);稀释后溶液分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(醋酸)___V(盐酸)。