题目内容
【题目】下列说法正确的是
A. 25℃水的电离常数是1.0×1014
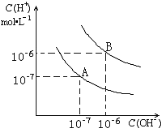
B. 中性溶液的c(H+)=![]()
C. 纯水在100℃时,c(H+)>107mol·L1,所以此时纯水中c(H+)>c(OH)
D. pH<7的溶液一定是酸溶液
【答案】B
【解析】
A. 25℃时,水的离子积常数是1.0×10-14,A错误;
B. 中性溶液中c(H+)=c(OH),又因为c(H+)·c(OH)=KW,所以溶液中的c(H+)=![]() ,B正确;
,B正确;
C. 水的电离吸热,加热促进电离,纯水在100℃时,c(H+)>10-7mol·L-1,但纯水显中性,所以此时纯水中c(H+)=c(OH),C错误;
D. pH<7的溶液不一定是酸溶液,与氢离子和氢氧根离子浓度的相对大小有关系,D错误;
答案选B。

【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有稀 | 试管口出现红棕色气体 | 溶液中的 |
B | 向某钠盐X溶液中加入盐酸,将产生的气体通入 | 有白色沉淀产生 | 反应生成的气体可能为 |
C | 向滴加酚酞的氨水中加蒸馏水稀释 | 溶液红色变浅 | 溶液中所有离子的浓度均减小 |
D | 用铂丝蘸取某溶液在酒精灯火焰上灼烧 | 直接观察,火焰呈黄色 | 溶液中的金属阳离子只有 |
A.AB.BC.CD.D
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2 ) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a__1×10-14(填“>”、“<”或“=”),作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后溶液中c(Na+):c(OH-)=___。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V2:V1=___。
(5)t2℃下,取相同体积、相同pH的醋酸和盐酸,各稀释100倍后其pH大小关系为:pH(醋酸)___pH(盐酸)(填“大于”、“小于”或“等于”。下同);稀释后溶液分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(醋酸)___V(盐酸)。