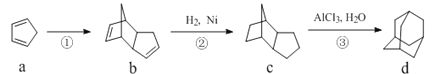
题目内容
【题目】NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1molK2Cr2O7被还原为Cr3+转移的电子数为3NA
B.0.1molCH4与Cl2在光照下反应生成的CH3Cl分子数为0.1NA
C.常温常压下,124gP4中所含P-P键数目4NA
D.标准状况下,22.4L丙烷中所含共价键数目为10NA
【答案】D
【解析】
A. Cr元素化合价由K2Cr2O7中+6价降低为Cr3+中+3价,则1mol K2Cr2O7被还原为Cr3+转移的电子数为(6-3)×2=6mol,即6NA,故A错误;
B. 1.0molCH4与Cl2在光照下反应,生成物是氯化氢和四种卤代烃,因此生成的CH3Cl分子数小于1.0NA,故B错误;
C. 常温常压下,124gP4的物质的量为![]() ,P4分子中所含6个P-P键,则124gP4中P-P键数目6NA,故C错误;
,P4分子中所含6个P-P键,则124gP4中P-P键数目6NA,故C错误;
D. 标准状况下,22.4L丙烷的物质的量为1mol,丙烷分子中含有10个共价键,则所含共价键数目为10NA,故D正确;
故选D。

【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2 ) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a__1×10-14(填“>”、“<”或“=”),作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后溶液中c(Na+):c(OH-)=___。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V2:V1=___。
(5)t2℃下,取相同体积、相同pH的醋酸和盐酸,各稀释100倍后其pH大小关系为:pH(醋酸)___pH(盐酸)(填“大于”、“小于”或“等于”。下同);稀释后溶液分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(醋酸)___V(盐酸)。