题目内容
7.短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| R | |||
| T | Q | W | |
| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 含T的盐中,T元素只能存在于阳离子中 |
分析 由短周期元素R、T、Q、W所处的位置,可确定T、Q、W为第三周期的元素,R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,可推知Q为Si元素,W为S元素,R为N元素.
A.非金属性越强,氢化物越稳定;
B.非金属性越强,最高价含氧酸的酸性越强;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
D.含有铝元素的盐溶液中可能为铝盐、可能为偏铝酸盐.
解答 解:由短周期元素R、T、Q、W所处的位置,可确定T、Q、W为第三周期的元素,R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,可推知Q为Si元素,W为S元素,R为N元素.
A.非金属性N>Si,故最简单气态氢化物的热稳定性为NH3>SiH4,故A正确;
B.非金属性Si<S,故最高价氧化物对应水化物的酸性为H2SiO3<H2SO4,故B正确;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:T>Q>R,故C正确;
D.T为铝元素,其盐溶液中可能为铝盐、可能为偏铝酸盐,故D错误;
故选D.
点评 本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识,难度中等,D选项为易错点,设问角度新颖独特,学生容易忽略偏铝酸盐.

练习册系列答案
相关题目
17.下列实验装置正确且能完成实验目的是( )
| A. | 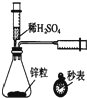 测定一定时间内生成H2的反应速率 | B. | 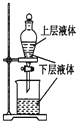 提取海带中的碘 | ||
| C. | 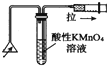 检验火柴燃烧产生的SO2 | D. | 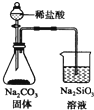 证明非金属性:Cl>C>Si |
15.如表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(3)小题用元素符号或化学式回答,(4)~(6)小题按题目要求回答.
(1)最高价氧化物的水化物碱性最强的物质是Mg(OH)2,呈两性的物质是Al(OH)3.
(2)A分别与D、E、F、G、H形成的化合物中,最稳定的物质是HF
(3)在B、C、E、F、G、H中,原子半径最大的是Mg
(4)A和E组成的最简单化合物的结构式
(5)用电子式表示B和H组成化合物的形成过程
(6)H的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式6H++Al2O3=2Al3++3H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)A分别与D、E、F、G、H形成的化合物中,最稳定的物质是HF
(3)在B、C、E、F、G、H中,原子半径最大的是Mg
(4)A和E组成的最简单化合物的结构式

(5)用电子式表示B和H组成化合物的形成过程

(6)H的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式6H++Al2O3=2Al3++3H2O.
2.Fenton试剂常用于氧化降解有机污染物X.在一定条件下,反应初始时c(X)=2.0×10-3 mol•L-1,反应10min进行测定,得图1和图2.下列说法不正确的是( )
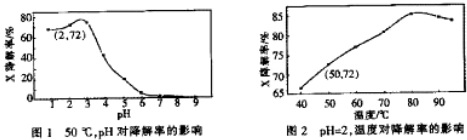

| A. | 温度为50℃,pH在3~6之间,X降解率随pH增大而减小 | |
| B. | pH=2,温度在40~80℃,X降解率温度升高而增大 | |
| C. | 无需再进行后续实验,就可以判断最佳反应条件是:pH=3、温度为80℃ | |
| D. | pH=2,温度为50℃,10min内v(X)=1.44×10-4 mol•L-1 min-1 |
12.关于下列装置说法正确的是( )
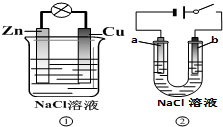

| A. | 装置①中的铜棒上冒气泡 | |
| B. | 若b是惰性电极,则装置②中的a、b 冒气泡 | |
| C. | 装置①换上硫酸铜溶液,将实现锌片上镀铜 | |
| D. | 装置②换上硫酸铜溶液,将实现“b极”镀铜 |
19.某稀溶液中含有4mol KNO3和2.5molH2SO4,向其中加入1.5mol Fe,充分反应(已知NO3-被还原为NO).下列说法正确的是( )
| A. | 反应后生成NO的体积为28 L | B. | 所得溶液中的溶质只有FeSO4 | ||
| C. | 所得溶液中c(NO3-)=2.75 mol.L-1 | D. | 所得溶液中c(Fe2+):c(Fe3+ )=1:1 |
16.下列物质中最难电离出H+的是( )
| A. | C6H5OH | B. | H2O | C. | HNO3 | D. | C2H5OH |