题目内容
19.某稀溶液中含有4mol KNO3和2.5molH2SO4,向其中加入1.5mol Fe,充分反应(已知NO3-被还原为NO).下列说法正确的是( )| A. | 反应后生成NO的体积为28 L | B. | 所得溶液中的溶质只有FeSO4 | ||
| C. | 所得溶液中c(NO3-)=2.75 mol.L-1 | D. | 所得溶液中c(Fe2+):c(Fe3+ )=1:1 |
分析 n(H+)=2.5mol×2=5mol,n(NO3-)=4mol,发生3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O或Fe+NO3-+4H+=Fe3++NO↑+2H2O,铁粉的物质的量为1.5mol,由离子方程式判断过量,然后设出未知数,结合反应列式计算即可.
解答 解:溶液中氢离子总物质的量为:n(H+)=2.5mol×2=5mol,n(NO3-)=4mol,铁粉的物质的量为1.5mol,
由 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,
3 2 8
1.5mol 1mol 4mol,
则1.5molFe完全反应时,硝酸根离子与氢离子均过量,
则发生Fe+NO3-+4H+=Fe3++NO↑+2H2O,
若1.5molFe完全反应时,氢离子不足,则两个反应均发生,
Fe+NO3-+4H+=Fe3++NO↑+2H2O
x 4x x
3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
y $\frac{8}{3}$y $\frac{2}{3}$y
则:x+y=1.5、4x+$\frac{8}{3}$y=5,
解得:x=0.75mol,y=0.75mol
生成NO的体积为(0.75mol+0.75mol×$\frac{2}{3}$)×22.4L/mol=28L,
A.根据分析可知,反应后生成标况下28LNO,不是标况下,NO气体不一定为28L,故A错误;
B.反应后溶质为硫酸铁和硫酸亚铁,故B错误;
C.反应消耗硝酸根离子等于生成NO的量=0.75mol+0.75mol×$\frac{2}{3}$=1.25mol,缺少溶液体积,无法计算溶液中硝酸根离子浓度,故C错误;
D.反应后生成铁离子为0.75mol,亚铁离子为0.75mol,所以所得溶液中c(Fe2+):c(Fe3+ )=1:1,故D正确;
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,题目难度中等,把握反应中电子守恒为解答的关键,注意过量判断及发生的反应判断,侧重分析与计算能力的考查;A、C为易错点,注意A不是标况下、C缺少溶液体积.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| A. | 是氢的一种新的同素异形体 | B. | 3g该新型氢粒子含电子2NA | ||
| C. | 是氢的一种新的同位素 | D. | 它的组成可用H3表示 |
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的化学能 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 醋酸逐渐凝固的过程要吸收能量 |
| R | |||
| T | Q | W | |
| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 含T的盐中,T元素只能存在于阳离子中 |
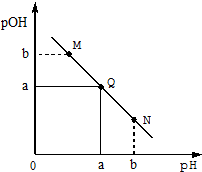 某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列
某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列说法错误的是( )
| A. | Q点消耗氨水溶液的体积等于HCl溶液的体积 | |
| B. | M点所示溶液导电能力弱于Q点 | |
| C. | M点和N点所示溶液中水的电离程度相同 | |
| D. | N点所示溶液中c(NH4+)>c(OH-) |
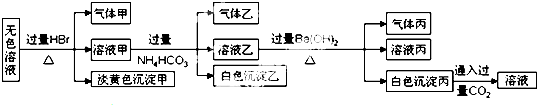
下列说法不正确的是( )
| A. | 淡黄色沉淀甲不可能为AgBr | |
| B. | 由溶液甲生成气体乙的途径只有:Al3++3HCO3-═Al(OH)3↓+3CO2↑ | |
| C. | 气体甲可能是混合气体 | |
| D. | 综合上述信息可以确定肯定存在的离子有:Na+、AlO2-、S2O32- |
| A. | 0.1 mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO32-)+c(HCO3-)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO32-)>c(HCO3-) | |
| D. | 0.2 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
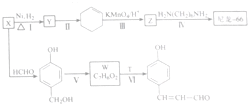

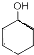 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,反应类型为消去反应
+H2O,反应类型为消去反应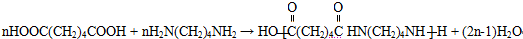 ,反应类型为缩聚反应
,反应类型为缩聚反应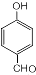 ,T的分子式为C2H4O
,T的分子式为C2H4O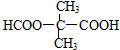 .
.