题目内容
2.Fenton试剂常用于氧化降解有机污染物X.在一定条件下,反应初始时c(X)=2.0×10-3 mol•L-1,反应10min进行测定,得图1和图2.下列说法不正确的是( )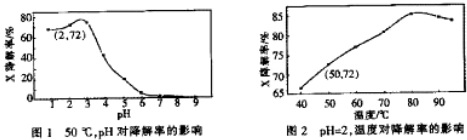
| A. | 温度为50℃,pH在3~6之间,X降解率随pH增大而减小 | |
| B. | pH=2,温度在40~80℃,X降解率温度升高而增大 | |
| C. | 无需再进行后续实验,就可以判断最佳反应条件是:pH=3、温度为80℃ | |
| D. | pH=2,温度为50℃,10min内v(X)=1.44×10-4 mol•L-1 min-1 |
分析 A.由图1分析50℃时,pH在3~6之间,X降解率随pH的变化规律;
B.由图2分析,pH=2时,温度在40~80℃,X降解率随温度的变化规律;
C.图1研究50℃时,pH对X降解率的影响,图2研究pH=2时,温度对X降解率影响,不能确定pH=3、温度为80℃对X降解率的影响;
D.由图2可知,PH=2,50℃时到达平衡时X的转化率为72%,据此计算X的浓度变化量,再根据v=$\frac{△c}{△t}$计算.
解答 解:A.由图1可知,50℃时,pH在3~6之间,X降解率随pH增大而减小,故A正确;
B.由图2可知,pH=2时,温度在40~80℃,X降解率温度升高而增大,故B正确;
C.溶液pH值、温度会影响X的降解率,需要进行pH=3、温度对X降解率影响实验或温度为80℃、pH对X降解率影响,故C错误;
D.由图2可知,PH=2,50℃时到达平衡时X的转化率为72%,X的浓度变化量=2.0×10-3mol•L-1×72%=1.44×10-3mol•L-1,故v(X)=$\frac{1.44×10{\;}^{-3}mol/L}{10min}$=1.44×10-4mol•L-1min-1,故D正确,
故选C.
点评 本题考查反应速率计算、化学平衡影响、阅读获取信息的能力、实验条件的控制等,侧重对学生能力的考查,难度中等.

练习册系列答案
相关题目
10.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.下列说法正确的是( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的化学能 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 醋酸逐渐凝固的过程要吸收能量 |
17.下列有关化学用语或名称表达正确的是( )
| A. | 聚丙烯的结构简式: | |
| B. | 乙炔的分子结构模型示意图: | |
| C. | H2O2的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| D. | 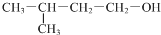 的名称:3-甲基-1-丁醇 的名称:3-甲基-1-丁醇 |
7.短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
| R | |||
| T | Q | W | |
| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 含T的盐中,T元素只能存在于阳离子中 |
14.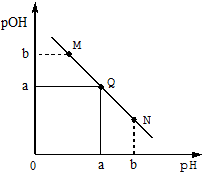 某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列
某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列
说法错误的是( )
 某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列
某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列说法错误的是( )
| A. | Q点消耗氨水溶液的体积等于HCl溶液的体积 | |
| B. | M点所示溶液导电能力弱于Q点 | |
| C. | M点和N点所示溶液中水的电离程度相同 | |
| D. | N点所示溶液中c(NH4+)>c(OH-) |
11.下列溶液中有关物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO32-)+c(HCO3-)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO32-)>c(HCO3-) | |
| D. | 0.2 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
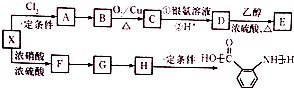
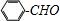 ;
;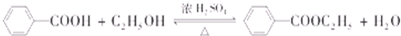 ;②
;②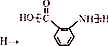 :
: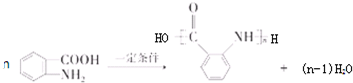 ;
;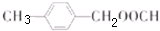 ;
;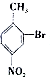 合成
合成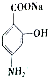 的转化流程图(写出反应物和反应条件).
的转化流程图(写出反应物和反应条件).