题目内容
12.关于下列装置说法正确的是( )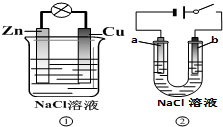
| A. | 装置①中的铜棒上冒气泡 | |
| B. | 若b是惰性电极,则装置②中的a、b 冒气泡 | |
| C. | 装置①换上硫酸铜溶液,将实现锌片上镀铜 | |
| D. | 装置②换上硫酸铜溶液,将实现“b极”镀铜 |
分析 ①装置是原电池装置,金属锌是负极,金属铜是正极,金属锌发生吸氧腐蚀;②是电解池,b是阳极,氯离子在该电极上发生失电子的氧化反应,a是阴极,该电极上是氢离子发生得电子的还原反应,据此回答判断.
解答 解:①装置是原电池装置,金属锌是负极,金属铜是正极,金属锌发生吸氧腐蚀;②是电解池,b是阳极,氯离子在该电极上发生失电子的氧化反应,a是阴极,该电极上是氢离子发生得电子的还原反应.
A、①装置是原电池装置,金属锌是负极,金属铜是正极,金属锌发生吸氧腐蚀装置,铜棒上是氧气得电子的还原反应,不会冒气泡,故A错误;
B、②是电解池,b是阳极,氯离子在该电极上发生失电子的氧化反应,产生氯气,a是阴极,该电极上是氢离子发生得电子的还原反应,产生氢气,故B正确;
C、装置①换上硫酸铜溶液,构成原电池,在铜电极上析出金属铜,不属于电解池中的电镀池,故C错误;
D、装置②换上硫酸铜溶液,在b极阳极上是氢氧根离子失电子生成氧气的反应,不会析出金属,故D错误.
故选B.
点评 本题考查学生原电池和电解池的工作原理知识,注意电极反应的书写以及两极反应伴随着的现象是关键,难度中等.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
3.关于化学反应A+B→C+D,下列说法中正确的是( )
| A. | 若生成物C和D分别是盐和水,则反应物一定是酸和碱 | |
| B. | 若A和C是单质,B和D是化合物,则该反应一定是置换反应 | |
| C. | 若A是可溶性碱,B是可溶性盐,则C和D一定是两种沉淀 | |
| D. | 若A、B各取10 g混合,使其充分反应,则C、D质量的总和一定等于20 g |
20.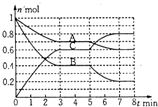 在一固定容积为2L的密闭容器中,气态物质A、B、C的物质量n(mol)随时间t(min)的变化如图所示.已知:平衡后,降低温度,A的转化率增大.下列选项中,能表明该反应一定达到平衡状态的是( )
在一固定容积为2L的密闭容器中,气态物质A、B、C的物质量n(mol)随时间t(min)的变化如图所示.已知:平衡后,降低温度,A的转化率增大.下列选项中,能表明该反应一定达到平衡状态的是( )
 在一固定容积为2L的密闭容器中,气态物质A、B、C的物质量n(mol)随时间t(min)的变化如图所示.已知:平衡后,降低温度,A的转化率增大.下列选项中,能表明该反应一定达到平衡状态的是( )
在一固定容积为2L的密闭容器中,气态物质A、B、C的物质量n(mol)随时间t(min)的变化如图所示.已知:平衡后,降低温度,A的转化率增大.下列选项中,能表明该反应一定达到平衡状态的是( )| A. | V正(A)=2V逆(B) | B. | 容器内混合气体的密度保持不变 | ||
| C. | 容器内的总压强保持恒定 | D. | A、B的转化率之比为1:2 |
7.短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
| R | |||
| T | Q | W | |
| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 含T的盐中,T元素只能存在于阳离子中 |
4.某无色溶液中可能含有以下离子中的一种或几种:Na+、Ag+、Fe3+、NH4+、Al3+、CO32-、AlO2-、S2O32-、SO42-.现取该溶液进行有关实验,实验结果如图所示:
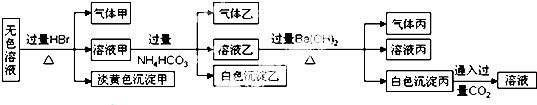
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 淡黄色沉淀甲不可能为AgBr | |
| B. | 由溶液甲生成气体乙的途径只有:Al3++3HCO3-═Al(OH)3↓+3CO2↑ | |
| C. | 气体甲可能是混合气体 | |
| D. | 综合上述信息可以确定肯定存在的离子有:Na+、AlO2-、S2O32- |
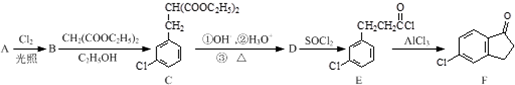
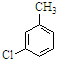 ,反应E→F的反应类型取代反应.
,反应E→F的反应类型取代反应.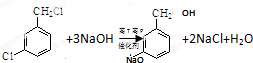 .
.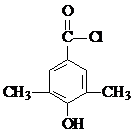 或
或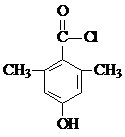 (任写一种).
(任写一种).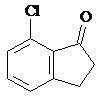
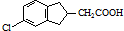 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下: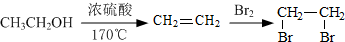
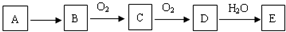
 ,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.
,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.