题目内容
18.某同学根据反应:SiO2+2C$\stackrel{高温}{→}$Si+2CO↑,得出结论:碳的非金属性强于硅的反应.请对此给予评价并说明理由:不正确.因为非金属性比较的是原子得电子能力,对于单质的氧化性越强,而该反应中C是还原剂,Si是还原产物,主要体现碳的还原性.分析 元素的非金属性是指元素的原子得电子的能力,得电子能力越强对应单质的氧化性越强,据此解答.
解答 解:元素的非金属性是指元素的原子得电子的能力,当元素的电子的时候,相当于化合价降级(例如由正1价到0),也就是被还原.
如果C的非金属性比Si更强,那么C比Si更容易还原,但是方程式中不体现这种情况,相反,它表达的是Si被还原了,C被氧化了,得出结论应是Si的非金属性比C更强,与题干结论相反,所以不正确;
故答案为:不正确.因为非金属性比较的是原子得电子能力,对于单质的氧化性越强,而该反应中C是还原剂,Si是还原产物,主要体现碳的还原性.
点评 本题考查了元素非金属性强弱的判断依据,明确元素非金属含义是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列有关化学用语表述不正确的是( )
| A. | 氨气分子的电子式: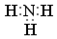 | B. | CO2分子的结构式:O=C=O | ||
| C. | S2-的结构示意图: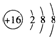 | D. | CH4的分子模型示意图为: |
9.最新科技报道,美国夏威夷联合天文中心的科学家发现了新型氢粒子,这种氢粒子是由3个氢原子核(只含质子)和2个电子构成的.对于这种粒子,下列说法中正确的是( )
| A. | 是氢的一种新的同素异形体 | B. | 3g该新型氢粒子含电子2NA | ||
| C. | 是氢的一种新的同位素 | D. | 它的组成可用H3表示 |
6.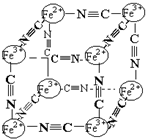 分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
 分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )| A. | 该晶体是原子晶体 | |
| B. | M的离子位于上述立方体的面心,呈+2价 | |
| C. | M的离子位于上述立方体的体心,呈+1价,且M+空缺率(体心中没有M+的占总体心的百分比)为50% | |
| D. | 晶体的化学式可表示为MFe2(CN)3,且M为+1价 |
3.关于化学反应A+B→C+D,下列说法中正确的是( )
| A. | 若生成物C和D分别是盐和水,则反应物一定是酸和碱 | |
| B. | 若A和C是单质,B和D是化合物,则该反应一定是置换反应 | |
| C. | 若A是可溶性碱,B是可溶性盐,则C和D一定是两种沉淀 | |
| D. | 若A、B各取10 g混合,使其充分反应,则C、D质量的总和一定等于20 g |
10.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.下列说法正确的是( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的化学能 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 醋酸逐渐凝固的过程要吸收能量 |
7.短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
| R | |||
| T | Q | W | |
| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 含T的盐中,T元素只能存在于阳离子中 |
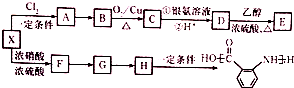
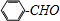 ;
; ;②
;②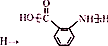 :
: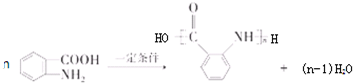 ;
;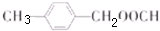 ;
;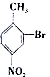 合成
合成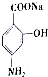 的转化流程图(写出反应物和反应条件).
的转化流程图(写出反应物和反应条件).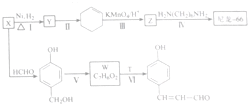

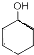 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,反应类型为消去反应
+H2O,反应类型为消去反应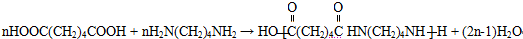 ,反应类型为缩聚反应
,反应类型为缩聚反应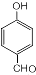 ,T的分子式为C2H4O
,T的分子式为C2H4O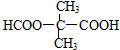 .
.