题目内容
17.将6g纯铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中,充分反应后得到200mL0.5mol/L的FeSO4溶液和5.2g固体.求:(1)反应后生成铜多少克?
(2)加入铁粉前Fe2(SO4)3的物质的量浓度.
分析 因氧化性Fe3+>Cu2+,则加入铁粉,先发生Fe+Fe2(SO4)3=3FeSO4,根据反应后溶液中亚铁离子的物质的量可知,5.2g固体沉淀物一定有铜,则后发生Fe+CuSO4=FeSO4+Cu,然后根据化学反应方程式列式计算即可.
解答 解:溶液中含有Fe2+:0.5mol•L-1×0.2L=0.1mol<$\frac{6g}{56g/mol}$,说明加入6g铁粉过量,
设硫酸铁的物质的量为x,生成铜的物质的量为y,
Fe+Fe2(SO4)3=3FeSO4
1mol 1mol 3mol
xmol xmol 3xmol
Fe+CuSO4=FeSO4+Cu 质量增加
1mol 1mol 1mol 1mol 64g-56g=8g
ymol ymol ymol ymol 8yg
则:①3x+y=0.1、②6g-56x+8y=5.2,
解得:x=0.02mol、y=0.04mol,
(1)故得生成铜质量为:0.04mol×64g•mol-1=2.56g,
答:反应后生成铜的质量为2.56g;
(2)原溶液中Fe2(SO4)3物质的量浓度为:$\frac{0.02mol}{0.2L}$=0.1mol/L,
答:原Fe2(SO4)3溶液的物质的量浓度为0.1mol/L.
点评 本题考查混合物反应的计算,题目难度中等,明确氧化性的强弱、反应的先后顺序是解答本题的关键,注意掌握差量法、质量守恒定律在化学计算中的应用.

练习册系列答案
相关题目
7.短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
| R | |||
| T | Q | W | |
| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 含T的盐中,T元素只能存在于阳离子中 |
5.常温下,1L pH=3的H2SO4溶液与下列溶液混合,其说法正确的是( )
| A. | 与等体积pH=11的氨水混合后所得溶液pH小于7 | |
| B. | 与pH=3的CH3COOH溶液混合后所得溶液pH小于3 | |
| C. | 与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7 | |
| D. | 与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |
12.已知H2O2的分子空间结构可在二面角中表示,如图所示,则有关H2O2的结构的说法中正确的是( )
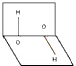

| A. | 分子的正、负电荷重心重合 | B. | 分子正、负电荷重心不重合 | ||
| C. | H2O2是极性分子 | D. | H2O2是非极性分子 |
13.(1)①比较0.1mol/L的下列各种溶液的pH大小:CH3COONa<NaClO;(填“>”、“<”或“=”)
②请按顺序排列出1mol/L (NH4)2SO4溶液中各种离子浓度大小关系c(NH4+)>c(SO42-)>c(H+)>c(OH-).
③25℃时,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10.混合溶液中由水电离出的c(H+)>0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8 kJ•mol-1
(3)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
①该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
②该反应为吸热反应(选填吸热、放热).
③能判断该反应是否达到化学平衡状态的依据是BC.
(A)容器中压强不变
(B)混合气体中[CO]不变
(C)v正(H2)=v逆(H2O)
(D)C(CO2)=C(CO)
②请按顺序排列出1mol/L (NH4)2SO4溶液中各种离子浓度大小关系c(NH4+)>c(SO42-)>c(H+)>c(OH-).
③25℃时,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10.混合溶液中由水电离出的c(H+)>0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8 kJ•mol-1
(3)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
②该反应为吸热反应(选填吸热、放热).
③能判断该反应是否达到化学平衡状态的依据是BC.
(A)容器中压强不变
(B)混合气体中[CO]不变
(C)v正(H2)=v逆(H2O)
(D)C(CO2)=C(CO)
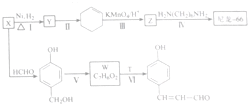

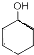 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,反应类型为消去反应
+H2O,反应类型为消去反应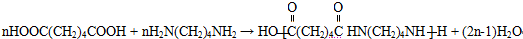 ,反应类型为缩聚反应
,反应类型为缩聚反应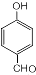 ,T的分子式为C2H4O
,T的分子式为C2H4O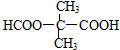 .
.