题目内容
16.下列物质中最难电离出H+的是( )| A. | C6H5OH | B. | H2O | C. | HNO3 | D. | C2H5OH |
分析 根据酸性越强电离生成H+越容易,则最难电离出H+的是酸性最弱的物质或非电解质,据此分析.
解答 解:A.苯酚显弱酸性,电离出氢离子的能力比水强;
B.水属于极弱电解质,能微弱电离生成H+;
C.硝酸是强酸,电离出氢离子能力强;
D.C2H5OH属于非电解质,在水中不电离,则不会电离出H+;
四种物质的酸性关系为HNO3>C6H6OH>H2O>C2H5OH,即最难电离出H+的是C2H5OH,
故选D.
点评 本题较简单,注重对学生基础知识的考查,明确酸性强弱与电离生成H+的关系是解答本题的关键.

练习册系列答案
相关题目
6.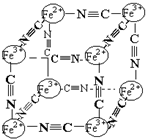 分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
 分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )| A. | 该晶体是原子晶体 | |
| B. | M的离子位于上述立方体的面心,呈+2价 | |
| C. | M的离子位于上述立方体的体心,呈+1价,且M+空缺率(体心中没有M+的占总体心的百分比)为50% | |
| D. | 晶体的化学式可表示为MFe2(CN)3,且M为+1价 |
7.短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
| R | |||
| T | Q | W | |
| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 含T的盐中,T元素只能存在于阳离子中 |
4.某无色溶液中可能含有以下离子中的一种或几种:Na+、Ag+、Fe3+、NH4+、Al3+、CO32-、AlO2-、S2O32-、SO42-.现取该溶液进行有关实验,实验结果如图所示:
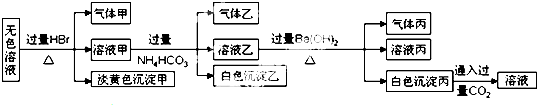
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 淡黄色沉淀甲不可能为AgBr | |
| B. | 由溶液甲生成气体乙的途径只有:Al3++3HCO3-═Al(OH)3↓+3CO2↑ | |
| C. | 气体甲可能是混合气体 | |
| D. | 综合上述信息可以确定肯定存在的离子有:Na+、AlO2-、S2O32- |
11.下列溶液中有关物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO32-)+c(HCO3-)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO32-)>c(HCO3-) | |
| D. | 0.2 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
5.常温下,1L pH=3的H2SO4溶液与下列溶液混合,其说法正确的是( )
| A. | 与等体积pH=11的氨水混合后所得溶液pH小于7 | |
| B. | 与pH=3的CH3COOH溶液混合后所得溶液pH小于3 | |
| C. | 与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7 | |
| D. | 与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |
12.已知H2O2的分子空间结构可在二面角中表示,如图所示,则有关H2O2的结构的说法中正确的是( )
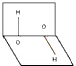

| A. | 分子的正、负电荷重心重合 | B. | 分子正、负电荷重心不重合 | ||
| C. | H2O2是极性分子 | D. | H2O2是非极性分子 |
 ,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.
,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.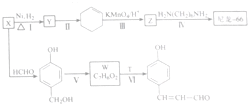

 $→_{△}^{浓硫酸}$
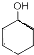
$→_{△}^{浓硫酸}$ +H2O,反应类型为消去反应
+H2O,反应类型为消去反应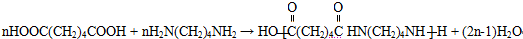 ,反应类型为缩聚反应
,反应类型为缩聚反应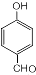 ,T的分子式为C2H4O
,T的分子式为C2H4O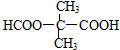 .
.