题目内容
2.下列关于元素周期表的叙述,不正确的是( )| A. | 共有7个周期,16个族 | |
| B. | 形成化合物种类最多的元素在第2周期 | |
| C. | 第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族 | |
| D. | 某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或RH2m-n |
分析 A.周期表有7个横行,18个纵行,7、8、9三个纵行为第ⅤⅢ族;
B.含C元素的化合价种类最多;
C.元素周期表中,短周期中ⅡA、ⅢA族相邻,长周期中ⅡA、ⅢA族中间为副族;
D.主族元素最高价氧化物对应的水化物的化学式为HnROm,R元素的化合价为2m-n,则氢化物中R元素的化合价为-(8-2m+n).
解答 解:A.周期表有7个横行,有7个周期;18个纵行,7、8、9三个纵行为第ⅤⅢ族,16个族,分别为7个主族、7个副族、1个0族、1个ⅤⅢ族,故A正确;
B.含C元素的化合价种类最多,C位于第2周期,故B正确;
C.元素周期表中,短周期中ⅡA、ⅢA族相邻,长周期中ⅡA、ⅢA族中间为副族,则第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族,故C正确;
D.主族元素最高价氧化物对应的水化物的化学式为HnROm,R元素的化合价为2m-n,则氢化物中R元素的化合价为-(8-2m+n),气态氢化物的化学式一定为H8-2m+nR或RH8-2m+n,故D错误;
故选D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期表的结构、元素的位置、元素化合物与化合物的关系等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
12.已知H2O2的分子空间结构可在二面角中表示,如图所示,则有关H2O2的结构的说法中正确的是( )
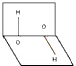

| A. | 分子的正、负电荷重心重合 | B. | 分子正、负电荷重心不重合 | ||
| C. | H2O2是极性分子 | D. | H2O2是非极性分子 |
13.(1)①比较0.1mol/L的下列各种溶液的pH大小:CH3COONa<NaClO;(填“>”、“<”或“=”)
②请按顺序排列出1mol/L (NH4)2SO4溶液中各种离子浓度大小关系c(NH4+)>c(SO42-)>c(H+)>c(OH-).
③25℃时,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10.混合溶液中由水电离出的c(H+)>0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8 kJ•mol-1
(3)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
①该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
②该反应为吸热反应(选填吸热、放热).
③能判断该反应是否达到化学平衡状态的依据是BC.
(A)容器中压强不变
(B)混合气体中[CO]不变
(C)v正(H2)=v逆(H2O)
(D)C(CO2)=C(CO)
②请按顺序排列出1mol/L (NH4)2SO4溶液中各种离子浓度大小关系c(NH4+)>c(SO42-)>c(H+)>c(OH-).
③25℃时,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10.混合溶液中由水电离出的c(H+)>0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8 kJ•mol-1
(3)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
②该反应为吸热反应(选填吸热、放热).
③能判断该反应是否达到化学平衡状态的依据是BC.
(A)容器中压强不变
(B)混合气体中[CO]不变
(C)v正(H2)=v逆(H2O)
(D)C(CO2)=C(CO)
17.下列实验中,不能观察到明显变化的是( )
| A. | 把一段打磨过的镁带放入少量冷水中 | |
| B. | 把Cl2通入FeCl2溶液中 | |
| C. | 把绿豆大的钾投入到水中 | |
| D. | 把溴水滴加到KI淀粉溶液中 |
14.Y元素最高正价与最低负价的绝对值之差是4,Y元素与M元素形成化合物M2Y,并在水中电离出电子层结构相同的离子,该化合物是( )
| A. | KCl | B. | Na2S | C. | Na2O | D. | K2S |
11.下列表述正确的是( )
| A. | 含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3-可共存 | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2 CO(g)+O2(g)反应的△H=+566.0kJ/mol | |
| C. | 将SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2 HClO | |
| D. | 在某钠盐溶液中含有等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中的一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有CO32- |
12.有关溴乙烷的下列叙述中,正确的是( )
| A. | 溴乙烷不溶于水,其密度比水的小 | |
| B. | 在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成 | |
| C. | 溴乙烷与NaOH的醇溶液混合共热可生成乙烯 | |
| D. | 溴乙烷通常用乙烷与液溴直接反应来制取 |
 .
.