题目内容
7.如图是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题: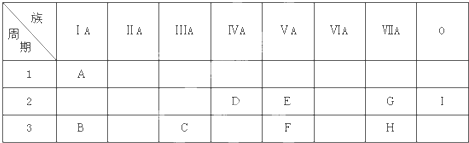
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na;
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)写出B和H形成的化合物的电子式
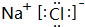 .
.
分析 由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为P,G为F,H为Cl,I为Ne.
(1)稀有气体化学性质最不活泼;氟元素没有最高正化合价;非金属性越强,单质氧化性越强,金属性越强,单质还原性越强;
(2)Na的金属性最强,则NaOH碱性增强,F元素没有含氧酸,高氯酸的酸性增强,氢氧化铝是两性氢氧化物;
(3)同周期自左而右非金属性最强,同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定;
(4)B和H形成的化合物为NaCl,由钠离子与氯离子构成.
解答 解:由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为P,G为F,H为Cl,I为Ne.
(1)稀有气体Ne的化学性质最不活泼;氟元素没有最高正化合价;上述元素中,F同时非金属性最强,故F2的氧化性最强,Na的金属性最强,故Na单质还原性最强,
故答案为:Ne;F;F2;Na;
(2)上述元素中,Na的金属性最强,则最高价氧化物的水化物NaOH的碱性最强,F元素没有含氧酸,高氯酸的酸性增强,上述元素中的最高价氧化物的水化物中只有Al(OH)3为两性,
故答案为:NaOH;HClO4;Al(OH)3;
(3)同周期自左而右非金属性最强,同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定,C、N、P、F、Cl中F的非金属性最强,则HF最稳定,
故答案为:HF;
(4)B和H形成的化合物为NaCl,由钠离子与氯离子构成,其电子式为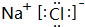 ,故答案为:
,故答案为: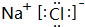 .
.
点评 本题考查元素周期表和元素周期律,需要学生熟练掌握元素周期表的结构,注意对元素周期律的理解,有利于基础知识的巩固.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
17.有一瓶K2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量样品溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀.对此实验下述结论正确的是( )
| A. | K2SO3已部分被空气中的氧气氧化 | |
| B. | 加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 | |
| C. | 加硝酸后的不溶性沉淀中含有BaSO3 | |
| D. | 此实验不能确定K2SO3是否部分被氧化 |
18.1mol CH4与Cl2发生取代反应,待反应完成后测得4种取代物的物质的量相等,则消耗的Cl2为( )
| A. | 0.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
2.下列关于元素周期表的叙述,不正确的是( )
| A. | 共有7个周期,16个族 | |
| B. | 形成化合物种类最多的元素在第2周期 | |
| C. | 第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族 | |
| D. | 某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或RH2m-n |
12.两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍为10L.下列各组混合烃中不符合此条件的是( )
| A. | CH4、C2H4 | B. | CH4、C3H6 | C. | C2H4、C3H4 | D. | CH4、C3H4 |
19.下列说法正确的是( )
| A. | H2O和H2O2中的化学键类型完全相同 | |
| B. | N2的结构式为N-N | |
| C. | 一个D216O分子所含的中子数为10 | |
| D. | NaCl的电子式为  |
 高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.
高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.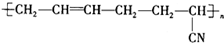 具有优良的耐油耐高温性能,合成丁腈橡胶的原料是( )
具有优良的耐油耐高温性能,合成丁腈橡胶的原料是( )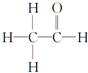 ,其PMR谱中有2个信号峰,其强度之比为3:1.
,其PMR谱中有2个信号峰,其强度之比为3:1.