题目内容
13.(1)①比较0.1mol/L的下列各种溶液的pH大小:CH3COONa<NaClO;(填“>”、“<”或“=”)②请按顺序排列出1mol/L (NH4)2SO4溶液中各种离子浓度大小关系c(NH4+)>c(SO42-)>c(H+)>c(OH-).
③25℃时,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10.混合溶液中由水电离出的c(H+)>0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8 kJ•mol-1
(3)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
②该反应为吸热反应(选填吸热、放热).
③能判断该反应是否达到化学平衡状态的依据是BC.
(A)容器中压强不变
(B)混合气体中[CO]不变
(C)v正(H2)=v逆(H2O)
(D)C(CO2)=C(CO)
分析 (1)①强酸弱碱盐溶液呈酸性、强碱弱酸盐溶液呈碱性,相同浓度的不同弱酸钠盐溶液中,酸根离子水解程度越大溶液碱性越强;
②硫酸铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,再结合电荷守恒判断铵根离子和硫酸根离子浓度大小,铵根离子水解但程度较小;
③根据溶液中水的离子积;
(2)根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式;
(3)①根据平衡常数等于生成物浓度幂之积除以反应物浓度幂之积计算;
②温度升高平衡常数增大,说明平衡向正反应方向移动;
③根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:(1)①相同浓度的醋酸钠和次氯酸钠,醋酸根离子水解程度小于次氯酸根离子,所以pHCH3COONa<NaClO;
故答案为:<;
②硫酸铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,所以c(H+)>c(OH-),再结合电荷守恒得c(NH4+)>c(SO42-),铵根离子水解但程度较小,所以离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);
③0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10,混合溶液中由水电离出的c(H+)=10-4,0.1mol/LNaOH溶液中由水电离出的c(H+)=10-13mol/L;所以混合溶液中由水电离出的c(H+)>0.1mol/LNaOH溶液中由水电离出的c(H+),
故答案为:>;
(2)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol;H2(g)+1/2O2(g)═H2O(g);△H=-241.8 kJ•mol-1;
(3)①平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,则K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,故答案为:$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;
(2)温度升高平衡常数增大,说明平衡向正反应方向移动,则正反应为吸热反应,故答案为:吸热;
③(A)容器中压强始终不变,级容器中压强不变的状态不一定平衡,故A错误;
(B)混合气体中[CO]不变是平衡状态的特征,故B正确;
(C)v正(H2)=v逆(H2O),正逆反应速率相等,但不为0,故C正确;
(D)C(CO2)=C(CO)可能是平衡状态,也可能不是,与各物质的初始浓度及转化率有关,故D错误;
故选BC.
点评 本题考查了热化学方程式的书写、离子浓度大小比较以及化学平衡状态的判断和有关计算知识,属于综合知识的考查,难度不大.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案| A. | C2H2 | B. | BeCl2 | C. | CO2 | D. | HClO |
| A. | 0.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
| A. | 简单离子半径的大小顺序为:rw>rz>ry | |
| B. | 元素W的氧化物对应水化物的酸性比Y的强 | |
| C. | X与Y形成的晶体XaYa的熔点高硬度大,为可替代金刚石的材料 | |
| D. | X与W形成的化合物和Z与W形成的化合物的化学类型相同 |
| A. | 共有7个周期,16个族 | |
| B. | 形成化合物种类最多的元素在第2周期 | |
| C. | 第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族 | |
| D. | 某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或RH2m-n |
| A. | CH3-CH2-CH2-CH3与 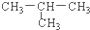 | B. | C3H8与C6H14 | ||
| C. | 乙烯和1,3-丁二烯 | D. | CH3CH2Cl 和CH2ClCH2CH2Cl |
 使用如图所示装置进行化学小实验,请填写下列空白:
使用如图所示装置进行化学小实验,请填写下列空白: