题目内容
在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg/cm3,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的是
①ω=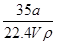 ×100% ②C=
×100% ②C= ③上述溶液中再加入VmL水后,所得溶液的质量分数大
③上述溶液中再加入VmL水后,所得溶液的质量分数大
于0.5ω ④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
| A.②④ | B.②③ | C.①③ | D.①④ |
A
解析试题分析:A、标准状况下aL的物质的量是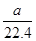 mol,氨气的质量=
mol,氨气的质量=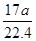 g,溶液的质量=ρg/cm3×Vml=ρVg。氨气溶于水,主要以NH3?H2O存在,但仍然以NH3作为溶质,则ω=×100%=
g,溶液的质量=ρg/cm3×Vml=ρVg。氨气溶于水,主要以NH3?H2O存在,但仍然以NH3作为溶质,则ω=×100%=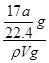 =
=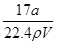 ×100%,故①错误;C==
×100%,故①错误;C== =
= mol/L,则②正确;氨水的密度小于水的密度,因此上述溶液中再加入VmL水后,溶液的质量大于原来的2倍,则所得溶液的质量分数小于0.5ω,③不正确;上述氨水中再加入等体积等浓度的稀盐酸后生成氯化铵,为强酸弱碱盐,NH4+水解溶液呈酸性,则溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故④正确,答案选A。
mol/L,则②正确;氨水的密度小于水的密度,因此上述溶液中再加入VmL水后,溶液的质量大于原来的2倍,则所得溶液的质量分数小于0.5ω,③不正确;上述氨水中再加入等体积等浓度的稀盐酸后生成氯化铵,为强酸弱碱盐,NH4+水解溶液呈酸性,则溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故④正确,答案选A。
考点:考查氨气溶于水溶液浓度的有关计算

 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案下列有关定量判断正确的是
| A.18gH218O分子中含有的10NA个质子 |
| B.将3mol NO2完全溶于水,生成NO气体,气体的物质的量变为2mol |
| C.将1.5molCO2气体通入到1L 1mol/L的NaOH溶液中,生成1mol碳酸钠 |
| D.2Cu2S+2H2SO4+5O2=4CuSO4+2H2O反应中,当1mol O2发生反应时,还原剂所失电子的物质的量 |
下列说法中不正确的是
| A.在标准状况下22.4LH2中含有的氢分子的个数为NA |
| B.1L1mol/L的KClO3溶液中含有的Cl-个数为NA |
| C.凡是溶于水能导电的化合物就是电解质 |
| D.某溶液中滴加烧碱溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定存在NH4+ |
有AlCl3和NaCl的混合溶液VL,将它均分成两份。一份滴加氨水,使Al3+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗a mol NH3·H2O、b mol AgNO3。据此得知原混合溶液中的c(Na+) (mol/L)为
| A.(2b-4a)/V | B.(b-a)/V | C.(2b-2a)/V | D.(b-2a)/V |
用10 mL 0.1 mol·L-1 BaCl2溶液,恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
| A.3∶2∶2 | B.1∶2∶3 | C.3∶1∶1 | D.1∶3∶3 |
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含离子如下表所示:
| 阳离子 | NH4+、Na+、Mg2+ |
| 阴离子 | OH-、NO3-、Cl- |
A.①② B.③④ C.③⑤ D.①⑤
下列溶液中的氯离子浓度 与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是( )
| A.150 mL 1 mol·L-1的NaCl | B.25 mL 2 mol·L-1的FeCl3 |
| C.150 mL 3 mol·L-1的KCl | D.75 mL 2 mol·L-1的CaCl2 |
下列叙述正确的是( )
| A.0.012 kg12C含有6.02×1023个碳原子 | B.1mol任何物质都含有6.02×1023个原子 |
| C.硫酸的摩尔质量是98g | D.常温常压下,1 mol氧气的体积为22.4L |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温常压下,17g羟基中含有的电子数目为10NA |
| B.常温常压下,28g由C2H4和C3H6组成的混合气体中含有的碳原子数目为2NA |
| C.0.05mol熔融的NaHSO4中含有的离子数目为0.15NA |
| D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |