题目内容
下列有关定量判断正确的是
| A.18gH218O分子中含有的10NA个质子 |
| B.将3mol NO2完全溶于水,生成NO气体,气体的物质的量变为2mol |
| C.将1.5molCO2气体通入到1L 1mol/L的NaOH溶液中,生成1mol碳酸钠 |
| D.2Cu2S+2H2SO4+5O2=4CuSO4+2H2O反应中,当1mol O2发生反应时,还原剂所失电子的物质的量 |
D
解析试题分析:A、H218O分子中含有的质子数是10,质量数是20,所以18gH218O分子中含有的9NA个质子,A不正确;B、NO2溶于水的方程式为3NO2+H2O=2HNO3+NO,所以将3mol NO2完全溶于水,生成NO气体,气体的物质的量变为1mol,B不正确;C、CO2与氢氧化钠的物质的量之比=3:2,所以将1.5molCO2气体通入到1L 1mol/L的NaOH溶液中,根据方程式CO2+NaOH=NaHCO3、CO2+2NaOH=Na2CO3+H2O可知CO2过量,生成1mol碳酸氢钠,C不正确;D、在2Cu2S+2H2SO4+5O2=4CuSO4+2H2O反应中,Cu2S是还原剂,氧气是氧化剂当。所以1mol O2发生反应时,氧气得到4mol电子,则根据电子得失守恒可知还原剂所失电子的物质的量为4mol,D正确,答案选D。
考点:考查物质的量、利用化学方程式以及氧化还原反应的有关计算

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
摩尔是( )
| A.国际单位制的一个基本物理量 | B.表示物质质量的单位 |
| C.计量微观粒子的物质的量的单位 | D.表示6.02×1023个粒子的集体 |
用NA表示阿伏德罗常数,下列叙述正确的是
| A.标准状况下,22.4L含有的分子数为1 NA |
| B.标准状况下,1.06g Na2CO3含有的Na+离子数为0.01 NA |
| C.通常状况下,NA个CO2分子质量为44 g |
| D.物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-个数为1 NA |
在标准状况下①6.72L CH4 ②3.01×1023个HCl分子③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是
| A.密度②>③>①>④ | B.体积②>③>①>④ |
| C.质量②>①>③>④ | D.氢原子个数①>③>②>④ |
某烷烃和烯烃的混合气体的密度是1.07 g·L-1(标准状况),该烷烃和烯烃的体积比是4∶1。这两种烃是
| A.CH4、C2H4 | B.C2H6、C2H4 | C.CH4、C4H8 | D.CH4、C3H6 |
实验室配制100mL 1.0 mol/L Na2CO3溶液,下列有关叙述正确的是
| A.用托盘天平称取10.6g Na2CO3固体 |
| B.将Na2CO3固体放入容量瓶中,加水至刻度线 |
| C.定容时俯视液面,所得溶液浓度偏低 |
| D.加水时不慎超过刻度线,用胶头滴管直接吸出多余液体 |
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是:
| A.体积相等时密度相等 | B.原子数相等时具有的中子数相等 |
| C.体积相等时具有的电子数相等 | D.质量相等时具有的质子数相等 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.1 mol N2所含有的原子数为NA |
| B.标准状况下,22.4 L水中含有的水分子数为NA |
| C.500 mL 1.0 mol/L碳酸钠溶液中所含钠离子的数为NA |
| D.0.5mol纯硫酸所含有的氧原子数与2NA个CO2分子中所含有的氧原子数相等 |
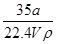 ×100% ②C=
×100% ②C=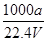 ③上述溶液中再加入VmL水后,所得溶液的质量分数大
③上述溶液中再加入VmL水后,所得溶液的质量分数大