题目内容
有AlCl3和NaCl的混合溶液VL,将它均分成两份。一份滴加氨水,使Al3+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗a mol NH3·H2O、b mol AgNO3。据此得知原混合溶液中的c(Na+) (mol/L)为
| A.(2b-4a)/V | B.(b-a)/V | C.(2b-2a)/V | D.(b-2a)/V |
C
解析试题分析:一份中滴加氨水,使Al3+离子完全沉淀,发生反应消耗a mol NH3·H2O,则n(Al3+)="a∕3" mol.n(AlCl3)=n(Al3+)="a∕3" mol. AlCl3和产生的氯离子n(Cl-)=amol,产生 另一份滴加AgNO3溶液,使Cl-离子完全沉淀,消耗b mol AgNO3。则n(Cl-)总="b" mol.则NaCl产生的氯离子n(Cl-)=(b-a)mol,n((Na+)=n(Cl-)=(b-a)mol,所以c(Na+)=n((Na+)∕V∕2="(b-a)mol∕V∕2L=(2b-2a)/V(" mol/L).所以正确选项为C。
考点:考查离子反应及物质的量浓度计算等的有关知识。

 名校课堂系列答案
名校课堂系列答案在标准状况下①6.72L CH4 ②3.01×1023个HCl分子③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是
| A.密度②>③>①>④ | B.体积②>③>①>④ |
| C.质量②>①>③>④ | D.氢原子个数①>③>②>④ |
用NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.1 mol N2所含有的原子数为NA |
| B.标准状况下,22.4 L水中含有的水分子数为NA |
| C.500 mL 1.0 mol/L碳酸钠溶液中所含钠离子的数为NA |
| D.0.5mol纯硫酸所含有的氧原子数与2NA个CO2分子中所含有的氧原子数相等 |
同温同压下,甲容器中HCI气体和乙容器中的NH。气体所含的原子个数相等,则甲、乙两容器的体积之比为
| A.2:1 | B.1:2 | C.1:l | D.1:4 |
当O2和O3的物质的量比之为3∶2时,它们具有相同的。
| A.原子数 | B.体积 | C.摩尔质量 | D.分子数 |
用NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A.7.1 g Cl2与足量NaOH溶液反应,转移的电子数为0.1 NA |
| B.在常温常压下,5.6 L CO中含有的原子数为0.5NA |
| C.4g NaOH固体中含有的离子总数为0.3 NA |
| D.13.5 g Al与足量盐酸反应生成H2的分子数为NA |
设NA为阿伏加德罗常数的值,下列叙述中正确的是
| A.1mol丙烷分子中,含有的非极性共价键数目为NA |
| B.标准状况下,1.8gH2O分子中所含有的电子数为NA |
| C.25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA |
| D.2.24L氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA |
设法把NO2和O2按4:1体积比充满一干燥的真空烧瓶中,然后把烧瓶置于水中,瓶内液面会逐渐上升,则最终烧瓶中所得溶液的物质的量浓度为(①气体体积为标准状况下测定 ②烧瓶中溶液不向外扩散)( )
| A.1/14mol/L | B.1/22.4mol/L | C.1/28mol/L | D.1/42mol/L |
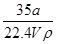 ×100% ②C=
×100% ②C=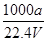 ③上述溶液中再加入VmL水后,所得溶液的质量分数大
③上述溶液中再加入VmL水后,所得溶液的质量分数大