题目内容
下列溶液中的氯离子浓度 与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是( )
| A.150 mL 1 mol·L-1的NaCl | B.25 mL 2 mol·L-1的FeCl3 |
| C.150 mL 3 mol·L-1的KCl | D.75 mL 2 mol·L-1的CaCl2 |
C
解析试题分析:50mL1 mol·L-1的AlCl3溶液中的Cl-浓度为3 mol·L-1,根据溶质化学式计算各选项中的Cl-物质的量,进行比较可知.注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度。A、1 mol·L-1的NaCl 中Cl-浓度为1 mol·L-1,错误;B、2 mol·L-1的FeCl3中Cl-浓度为6 mol·L-1,错误;C、3 mol·L-1的KCl 中Cl-浓度为3 mol·L-1,正确;D、2 mol·L-1的CaCl2 Cl-浓度为4 mol·L-1,错误。
考点:考查物质的量浓度的概念和计算。

练习册系列答案
相关题目
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是:
| A.体积相等时密度相等 | B.原子数相等时具有的中子数相等 |
| C.体积相等时具有的电子数相等 | D.质量相等时具有的质子数相等 |
当O2和O3的物质的量比之为3∶2时,它们具有相同的。
| A.原子数 | B.体积 | C.摩尔质量 | D.分子数 |
现有两种金属的混合物共4克,与足量氯气反应后,固体增重7.1克。另取4克该金属混合物,投入到足量盐酸中,产生2.24L(标准状况)H2。则该混合物的组成不可能是
①Cu,Al ②Mg,Fe ③Zn,Al ④Mg,Zn
| A.①② | B.③④ | C.①③ | D.②④ |
设NA为阿伏加德罗常数的值,下列叙述中正确的是
| A.1mol丙烷分子中,含有的非极性共价键数目为NA |
| B.标准状况下,1.8gH2O分子中所含有的电子数为NA |
| C.25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA |
| D.2.24L氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA |
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
| A.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2 NA |
| B.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA |
C.a g某气体含分子数为b,c g该气体在标况下的体积为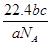 L L |
| D.某密闭容器盛有0.1 molN2和0.3 molH2,在一定条件下充分反应,转移电子的数目为0.6 NA |
设NA代表阿伏加德罗常数,下列叙述正确的是 ( )
| A.标准状况下2.24 L H2O中,分子数为0.1NA |
| B.将1mol Cl2通入到水中,则N(HClO)+ N(Cl?)+ N(ClO-)= 2NA |
| C.常温常压下16g O2和O3混合气体中,氧原子数为NA |
| D.7.8g Na2O2与足量水反应,转移电子数为0.2NA |
设NA为阿伏加德罗常数的数值,下列叙述中正确的是
| A.常温常压下,100g8.5%的H2O2水溶液中含氧原子总数为NA |
| B.标准状况下,NA个H2O分子所占的休积为22.4L |
| C.标准状况下,2.24L乙烯分子中σ键为0.1NA |
| D.常温常压下,4.8g臭氧与4.8g氧气所含的氧原子数均为0.3NA |
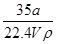 ×100% ②C=
×100% ②C=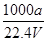 ③上述溶液中再加入VmL水后,所得溶液的质量分数大
③上述溶液中再加入VmL水后,所得溶液的质量分数大