题目内容
下列说法中不正确的是
| A.在标准状况下22.4LH2中含有的氢分子的个数为NA |
| B.1L1mol/L的KClO3溶液中含有的Cl-个数为NA |
| C.凡是溶于水能导电的化合物就是电解质 |
| D.某溶液中滴加烧碱溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定存在NH4+ |
BC
解析试题分析:A、在标准状况下22.4LH2的物质的量=22.4L÷22.4L/mol=1mol,因此分子中含有的氢分子的个数为NA,A正确;B、氯酸钾溶于水不能电离出氯离子,而是K+与ClO3-,所以选项B不正确;C、溶于水或在熔融状态下能够自身电离出离子的化合物是电解质,因此溶于水能导电的化合物不一定是电解质,例如SO2等是非电解质,C不正确;D、某溶液中滴加烧碱溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体,该气体一定是氨气,则原溶液中一定存在NH4+,D正确,答案选BC。
考点:考查物质的量的计算、电解质判断以及NH4+检验

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用NA表示阿伏德罗常数,下列叙述正确的是
| A.标准状况下,22.4L含有的分子数为1 NA |
| B.标准状况下,1.06g Na2CO3含有的Na+离子数为0.01 NA |
| C.通常状况下,NA个CO2分子质量为44 g |
| D.物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-个数为1 NA |
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是:
| A.体积相等时密度相等 | B.原子数相等时具有的中子数相等 |
| C.体积相等时具有的电子数相等 | D.质量相等时具有的质子数相等 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.1 mol N2所含有的原子数为NA |
| B.标准状况下,22.4 L水中含有的水分子数为NA |
| C.500 mL 1.0 mol/L碳酸钠溶液中所含钠离子的数为NA |
| D.0.5mol纯硫酸所含有的氧原子数与2NA个CO2分子中所含有的氧原子数相等 |
某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A.所用NaOH已经潮解 |
| B.向容量瓶中加水未到刻度线 |
| C.有少量NaOH溶液残留在烧杯里 |
| D.用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法 |
同温同压下,甲容器中HCI气体和乙容器中的NH。气体所含的原子个数相等,则甲、乙两容器的体积之比为
| A.2:1 | B.1:2 | C.1:l | D.1:4 |
当O2和O3的物质的量比之为3∶2时,它们具有相同的。
| A.原子数 | B.体积 | C.摩尔质量 | D.分子数 |
设NA代表阿伏加德罗常数,下列叙述正确的是 ( )
| A.标准状况下2.24 L H2O中,分子数为0.1NA |
| B.将1mol Cl2通入到水中,则N(HClO)+ N(Cl?)+ N(ClO-)= 2NA |
| C.常温常压下16g O2和O3混合气体中,氧原子数为NA |
| D.7.8g Na2O2与足量水反应,转移电子数为0.2NA |
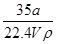 ×100% ②C=
×100% ②C=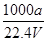 ③上述溶液中再加入VmL水后,所得溶液的质量分数大
③上述溶液中再加入VmL水后,所得溶液的质量分数大