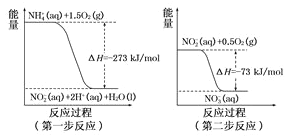
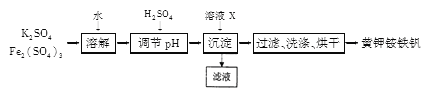
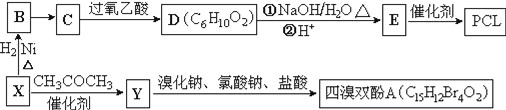
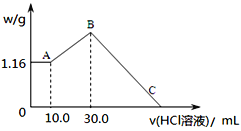
题目内容
【题目】某研究小组在实验室进行硫的化合物系列实验。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。
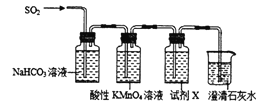
(1)试剂X的作用是_______。
(2)当观察到_______,即证明H2SO3的酸性比H2CO3强。
Ⅱ.研究铁与硫酸的反应。
已知: 浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
实验 | 试剂 | 现象 | |
| 1 | 螺旋状铁丝、稀硫酸 | 铁丝表面有大量气体产生。 |
2 | 螺旋状铁丝、浓硫酸 | 铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止。 | |
(3)上述实验中,铁丝绕成螺旋状的目的是_______。
(4)实验1中,铁与稀硫酸反应的离子方程式为_______。
(5)实险2中的现象常被称为_______。
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。

(6)A中产生的气体是_______; 请设计实验方案检测装置A的溶液中含有Fe3+_______ (简要说明操作、试剂、现象和结论)。
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有_______。
【答案】 检验SO2是否除尽 品红溶液不褪色,澄清石灰水变浑浊 增大铁丝与硫酸的接触面积,加快反应速率,使反应充分进行 Fe+2H+=Fe2++H2↑ 钝化 SO2 取少量溶液,滴加KSCN溶液,若溶液呈血红色则证明有Fe3+存在 反应的温度、反应物的浓度、反应物用量
【解析】Ⅰ. (1)由装置图分析可知,用酸性高锰酸钾除去未反应的SO2,为确保进入澄清石灰水中的气体为CO2,试剂X应该是品红溶液,用来检验SO2是否除尽;
(2)当观察到品红溶液不褪色,澄清石灰水变浑浊,即说明SO2把CO2置换出来了,即证明H2SO3的酸性比H2CO3的强;
Ⅱ.(3)铁丝绕成螺旋状的目的增大铁丝与硫酸的接触面积,加快反应速率;
(4)实验1中,铁与稀硫酸反应的离子方程式为Fe+2H+=Fe2++H2↑;
(5)实险2中的现象是铁丝表面迅速发黑(Fe3O4),说明浓硫酸具有强的氧化性,迅速在铁的表面氧化生成致密的氧化膜,即黑色的Fe3O4,并有少量气体产生,但反应很快停止是由于致密的氧化膜阻止了浓硫酸与铁的进一步接触,使反应停止了,这种现象被称为钝化;
(6)试管B中品红溶液褪色,说明A中产生的气体是SO2;检测装置A的溶液中含有Fe3+,可取少量该溶液,滴加几滴KSCN溶液,若溶液呈血红色则证明有Fe3+存在;
(7)实验1说明稀硫酸与铁反应生成H2,实验2说明浓硫酸在常温下使铁钝化,故实验1和实验2比较可知,硫酸的浓度影响着铁和硫酸反应的产物;实验3说明浓硫酸在加热时与铁反应,产生大量的SO2气体,所以实验2和实验3比较可得,反应的温度影响着铁和硫酸反应的产物;但随着反应的进行,浓硫酸逐渐变为稀硫酸,而稀硫酸与铁反应将产生具有可燃性的H2,可是在实验3的D处始终未检测到可燃性气体,说明浓硫酸的用量非常大,由此分析反应物的浓度、反应的温度和反应物用量都是影响铁和硫酸反应产物多样性的因素。

 阅读快车系列答案
阅读快车系列答案