题目内容
【题目】在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是_______。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中
B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下
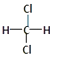
C.铁单质与水蒸气反应的化学方程式为:2Fe+3H2O(g)![]() Fe2O3+3H2
Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
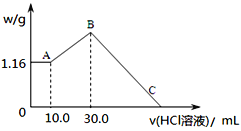
①A点的沉淀物的化学式为______________。
②写出A点至B点发生反应的离子方程式:_________________。
③某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为:NaOH溶液、_______和盐酸。
④C点(此时沉淀恰好完全溶解)HCl溶液的体积为________mL。
【答案】 A Mg(OH)2 AlO2-+H++H2O= Al(OH)3↓ CO2 130.0(130也给分)
【解析】(1)金属钠非常活泼,能够与水、氧气等物质发生反应,但与石蜡油或煤油不反应,可以保存在石蜡油或煤油中,A正确;铝的熔点低,加热后会熔化,但铝在氧气中燃烧生成氧化铝,因为氧化铝的熔点高,加热时氧化膜包裹着内层的熔化的铝而不会低落,B错误;铁单质与水蒸气反应生成四氧化三铁而非氧化铁,C错误;正确选项A。
(2)从题给信息中可知:产生的白色沉淀加盐酸后,沉淀质量不变,说明原溶液中氢氧化钠过量,所以1.16g白色沉淀为氢氧化镁,而氢氧化铝沉淀溶于过量的氢氧化钠,溶液中存在偏铝酸根离子,继续加盐酸,会发生AlO2-+H++H2O= Al(OH)3↓ ,沉淀达到最大值,为氢氧化镁和氢氧化铝沉淀质量之和(B点);接着再加入足量的盐酸,两种沉淀都溶于酸中,沉淀消失;
①A点的沉淀物为氢氧化镁,化学式为Mg(OH)2;正确答案:Mg(OH)2。
②写出A点至B点发生反应为偏铝酸根离子与适量盐酸反应生成氢氧化铝沉淀,离子方程式: AlO2-+H++H2O= Al(OH)3↓;正确答案:AlO2-+H++H2O= Al(OH)3↓。
③含有MgCl2和AlCl3的混合液中,先加入足量的氢氧化钠溶液,生成氢氧化镁沉淀和偏铝酸钠溶液,过滤,得到沉淀氢氧化镁,再加适量的盐酸,生成MgCl2;滤液为偏铝酸钠溶液,通入足量二氧化碳气体,生成氢氧化铝沉淀和碳酸氢钠溶液,过滤得到沉淀固体,再加入适量盐酸,得到AlCl3,从而实现二者的分离;正确答案:CO2。
④根据上述分析可知:氢氧化镁沉淀质量为1.16克,物质的量为0.02 mol,A→B过程为AlO2-+H++H2O= Al(OH)3↓,共消耗盐酸的量为(30-10)×10-3×1=0.02 mol,生成Al(OH)3沉淀的量为0.02 mol,两种沉淀恰好与盐酸反应只生成氯化镁和氯化铝溶液,根据氯离子守恒可得:V(HCl)×1=0.02×2+0.02×3=0.1, V(HCl)=0.1L=100mL, C点(此时沉淀恰好完全溶解)HCl溶液的体积为30+100=130.0 mL,正确答案:130.0(130也给分)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某研究小组在实验室进行硫的化合物系列实验。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。

(1)试剂X的作用是_______。
(2)当观察到_______,即证明H2SO3的酸性比H2CO3强。
Ⅱ.研究铁与硫酸的反应。
已知: 浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
实验 | 试剂 | 现象 | |
| 1 | 螺旋状铁丝、稀硫酸 | 铁丝表面有大量气体产生。 |
2 | 螺旋状铁丝、浓硫酸 | 铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止。 | |
(3)上述实验中,铁丝绕成螺旋状的目的是_______。
(4)实验1中,铁与稀硫酸反应的离子方程式为_______。
(5)实险2中的现象常被称为_______。
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。
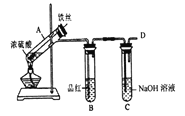
(6)A中产生的气体是_______; 请设计实验方案检测装置A的溶液中含有Fe3+_______ (简要说明操作、试剂、现象和结论)。
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有_______。