题目内容
【题目】按要求回答下列问题:
(1)标准状况下,1.12LCH4的质量为_______g。
(2)与3.2gSO2所含的O原子数相等的NO2的质量为_______g。
(3)配制500mL1.0mol·L-1CuSO4溶液时,在移液洗涤后,摇动容量瓶有少量液体溅出,则所配溶液物质的量浓变会_______(选填“偏高”、“偏低”、“无影响”)。
(4)把2.0mol·L-1Na2SO4溶液和1.0mol·L-1H2SO4溶液等体积混合(假设混合后溶液的体积为两者体积之和),则SO42-的物质的量浓度为_______mol·L-1。
(5)浓氨水可用于检验氯气管道是否漏气,其原理是8NH3+3Cl2=6NH4Cl+N2。该反应中氧化剂与还原剂的物质的最之比为_______。
【答案】 0.8g 2.3g 偏低 1.5 3∶2
【解析】(1)标准状况下,气体摩尔体积为22.4L/mol,CH4的摩尔质量为16g/mol,所以1.12LCH4的质量=![]() ×16g/mol=0.8g;
×16g/mol=0.8g;
(2)已知SO2的摩尔质量为64g/mol,则3.2gSO2所含的O原子的物质的量为![]() 0.1mol,又NO2的摩尔质量为46g/mol,则含有0.1molO原子的NO2的物质的量为0.05mol,其质量为0.05mol×46g/mol=2.3g;
0.1mol,又NO2的摩尔质量为46g/mol,则含有0.1molO原子的NO2的物质的量为0.05mol,其质量为0.05mol×46g/mol=2.3g;
(3)在移液洗涤后,摇动容量瓶有少量液体溅出,导致溶质量减少,使所配溶液物质的量浓度偏低;
(4)设两种溶液的体积都是1L,则2.0mol·L-1Na2SO4溶液中n(SO42-)=1L×2.0mol·L-1=2.0mol,1.0mol·L-1H2SO4溶液n(SO42-)=1L×1.0mol·L-1=1.0mol,所以混合后溶液中的n(SO42-)=3.0mol,故c(SO42-)=![]() =1.5mol·L-1;
=1.5mol·L-1;
(5)已知反应8NH3+3Cl2=6NH4Cl+N2中Cl元素的化合价从0价降低为-1价,Cl2作氧化剂,N元素化合价从-3价升高为0价,NH3作还原剂,根据转移电子守恒可得氧化剂与还原剂的物质的最之比 3∶2。

【题目】某研究小组在实验室进行硫的化合物系列实验。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。

(1)试剂X的作用是_______。
(2)当观察到_______,即证明H2SO3的酸性比H2CO3强。
Ⅱ.研究铁与硫酸的反应。
已知: 浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
实验 | 试剂 | 现象 | |
| 1 | 螺旋状铁丝、稀硫酸 | 铁丝表面有大量气体产生。 |
2 | 螺旋状铁丝、浓硫酸 | 铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止。 | |
(3)上述实验中,铁丝绕成螺旋状的目的是_______。
(4)实验1中,铁与稀硫酸反应的离子方程式为_______。
(5)实险2中的现象常被称为_______。
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。
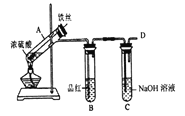
(6)A中产生的气体是_______; 请设计实验方案检测装置A的溶液中含有Fe3+_______ (简要说明操作、试剂、现象和结论)。
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有_______。
【题目】工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol 在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1<T2
C.a<0
D.平衡常数:K(T1)<K(T2)