题目内容
【题目】黄钾铵铁矾[KNH4Fex(SO4)y(OH)z] 不溶于水和稀硫酸,制取流程如下:

请回答下列问题:
(1)溶液X是_______。
(2)在黄钾铵铁矾[KNH4Fex(SO4)y(OH)z] 中,x、y、z的代数关系式为_______。
(3)检验滤液中是否存 在K+的操作是_______。
(4)黄钾铵铁矾的化学式可通过下列实验测定:
步骤1: 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶配制成100.00mL 溶液A。
步骤2: 最取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32g。
步骤3: 量取25.00mL溶液A,加入足最NaOH溶液,加热,收集到标准状下气体224mL,同时有红褐色沉淀生成。
步骤4: 将步骤3所得沉淀过滤、洗涤、灼烧,最终得固体4.80g。
①步骤1配制溶液A所需的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还需_______。
②根据以上实验数据计算黄钾铵铁矾中的n(OH-)∶n(SO42-)的比值为_______。(写出必要的计算过程,否则不得分)
【答案】 氨水(或写"NH3·H2O") 3x+2=2y+z 用洁净的铂丝(或铁丝)蘸取滤液在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,若火焰呈紫色,则存在K+。(没有写“蓝色钴玻璃”不扣分) 100mL容量瓶 n(SO42-)=n(BaSO4)= ![]() =0.04 mol,n(NH4+) =n(NH3) =
=0.04 mol,n(NH4+) =n(NH3) =![]() =0.01mol,n(Fe3+)= 2n(Fe2O3)= 2×
=0.01mol,n(Fe3+)= 2n(Fe2O3)= 2×![]() = 0.06 mol,n(K+)=n(NH4+)=0.01mol ,根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)=0.12mol,n(OH-) ∶n(SO42-)=3∶1
= 0.06 mol,n(K+)=n(NH4+)=0.01mol ,根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)=0.12mol,n(OH-) ∶n(SO42-)=3∶1
【解析】(1)根据最终产物的组成成分中含有NH4+和OH-,而已知原料K2SO4和Fe2(SO4)3中没有,所以溶液X为氨水;
(2)根据黄钾铵铁矾的分子组成KNH4Fex(SO4)y(OH)z,结合化合价规则即得x、y、z的代数关系式为3x+2=2y+z;
(3)K+的检验只有用焰色反应,其操作是用洁净的铂丝(或铁丝)蘸取滤液在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,若火焰呈紫色,则存在K+;
(4)① 步骤1配制溶液A所需的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还需100mL容量瓶;②根据操作步骤分析可知,加入盐酸酸化的BaCl2溶液生成9.32g白色固体为BaSO4,即n(BaSO4)=n(SO42-)= ![]() = 0.04mol,加入足最NaOH溶液,加热,收集到标准状下气体224mL为NH3,即n(NH4+)=n(NH3)=
= 0.04mol,加入足最NaOH溶液,加热,收集到标准状下气体224mL为NH3,即n(NH4+)=n(NH3)=![]() =0.01mol,生成红褐色沉淀为Fe(OH)3,经洗涤、灼烧,最终得固体4.80g为Fe2O3,所以有n(Fe3+)=2n(Fe2O3) = 2×
=0.01mol,生成红褐色沉淀为Fe(OH)3,经洗涤、灼烧,最终得固体4.80g为Fe2O3,所以有n(Fe3+)=2n(Fe2O3) = 2×![]() =0.06mol,由该物质的化学式可知n(K+)=n(NH4+)=0.01mol,再根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)=0.12mol,所以n(OH-)∶n(SO42-)=0.12mol∶0.04mol=3∶1。
=0.06mol,由该物质的化学式可知n(K+)=n(NH4+)=0.01mol,再根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)=0.12mol,所以n(OH-)∶n(SO42-)=0.12mol∶0.04mol=3∶1。

【题目】某研究小组在实验室进行硫的化合物系列实验。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。

(1)试剂X的作用是_______。
(2)当观察到_______,即证明H2SO3的酸性比H2CO3强。
Ⅱ.研究铁与硫酸的反应。
已知: 浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
实验 | 试剂 | 现象 | |
| 1 | 螺旋状铁丝、稀硫酸 | 铁丝表面有大量气体产生。 |
2 | 螺旋状铁丝、浓硫酸 | 铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止。 | |
(3)上述实验中,铁丝绕成螺旋状的目的是_______。
(4)实验1中,铁与稀硫酸反应的离子方程式为_______。
(5)实险2中的现象常被称为_______。
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。
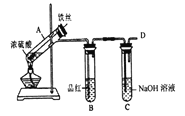
(6)A中产生的气体是_______; 请设计实验方案检测装置A的溶液中含有Fe3+_______ (简要说明操作、试剂、现象和结论)。
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有_______。

