题目内容
19.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色.五种元素核电荷数之和为54,最外层电子数之和为20.W、Z最外层电子数相同,Z的核电荷数是W的2倍.工业上一般通过电解氧化物的方法获得Y的单质.则下列说法不正确的是( )| A. | 原子半径:X>Y>Q>W | |
| B. | Q和Z所形成的分子空间构型为直线形 | |
| C. | Q和W可形成原子个数比为1:1和2:1的常见化合物 | |
| D. | X、Y和W三种元素形成的化合物的水溶液呈碱性 |
分析 Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色,则X为钠元素;工业上一般通过电解氧化物的方法获得Y的单质,则Y为铝元素;W、Z最外层电子数相同,二者为同主族,Z的核电荷数是W的2倍,则W为氧元素,Z为硫元素;五种元素最外层电子数之和为20,五种元素核电荷数之和为54,则Q的核电荷数为54-11-13-8-16=6,故Q为碳元素,结合元素周期律及物质性质回答.
解答 解:Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色,则X为钠元素;工业上一般通过电解氧化物的方法获得Y的单质,则Y为铝元素;W、Z最外层电子数相同,二者为同主族,Z的核电荷数是W的2倍,则W为氧元素,Z为硫元素;五种元素最外层电子数之和为20,五种元素核电荷数之和为54,则Q的核电荷数为54-11-13-8-16=6,故Q为碳元素.
A.同周期从左向右原子半径在减小,同主族自上而下原子半径增大,所以原子半径为X(Na)>Y(Al)>Q(C)>W(O),故A正确;
B.Q和Z所形成的分子为CS2,与CO2相似,空间构型为直线型,故B正确;
C.Q和W可形成原子个数比为1:1和1:2的化合物分别为CO、CO2,故C错误;
D.X、Y和W三种元素形成的化合物为NaAlO2,为强碱弱酸盐,水解显碱性,故D正确,
故选:C.
点评 考查元素位置结构性质的关系及应用,难度中等,元素推断是关键,学习中注重相关基础知识的积累.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
7.下列关于甲、乙、丙、丁四个图象的说法中,正确的是( )

| A. | 甲是亚硫酸氢钠粉末投入稀硝酸溶液中的有关图象 | |
| B. | 乙是等pH的MCl2和NCl2溶液稀释时pH变化图象,由此可推测M的金属性较强 | |
| C. | 由丙可知,双氧水在有催化剂存在时的热化学方程式为2H2O2(l)═2H2O(l)+O2(g)△H=-2(Ea2′-Ea2) kJ•mol-1 | |
| D. | 丁是向硝酸银溶液中滴加氨水时,沉淀质量与氨的物质的量的关系图象 |
4.近年来,我国大力倡导使用乙醇汽油.关于乙醇汽油与普通汽油,下列说法正确的是( )
| A. | 乙醇汽油比普通汽油保质期长 | |
| B. | 使用乙醇汽油可减少大气雾霾 | |
| C. | 区别两者可用测沸点的方法,普通汽油沸点高 | |
| D. | 区别两者可加入水中,只有普通汽油能分层 |
11.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,不一定能产生沉淀的是( )
| 序号 | 甲 | 乙 | 丙 |
| A | CO2 | SO2 | 澄清石灰水 |
| B | HCl | CO2 | Ba(OH)2 |
| C | CO2 | SO2 | Ba(NO3)2 |
| D | CO2 | NH3 | CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
8.化学与生产、生活、社会密切相关,下列说法不正确的是( )
| A. | 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂 | |
| B. | 发泡塑料饭盒主要材质是高分子材料,不适于盛放含油较多的食品 | |
| C. | 蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 | |
| D. | 纯净的二氧化硅是现代光学及光纤制品的基本原料 |
9.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol二甲醚中含有的C-O键的数目为2NA | |
| B. | 标准状况下,44.8 L四氯化碳中含有分子的数目为2NA | |
| C. | 200 g质量分数为23%的HCOOH水溶液中含氧原子的总数目为2NA | |
| D. | 在反应Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,每生成1 molCu,转移电子的数目为2NA |
 Fe(OH)3 + 3 H+,下列操作能使FeCl3的水解程度增大且溶液的酸性增强的是( )
Fe(OH)3 + 3 H+,下列操作能使FeCl3的水解程度增大且溶液的酸性增强的是( )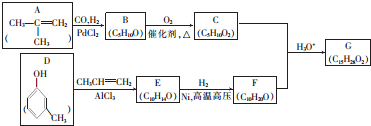
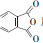 反应可生成1mol百里酚酞
反应可生成1mol百里酚酞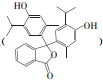
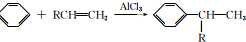
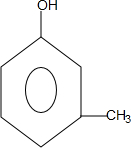 +CH3CH=CH2$\stackrel{AlCl_{3}}{→}$
+CH3CH=CH2$\stackrel{AlCl_{3}}{→}$ ;B→C的化学方程式为2(CH3)2CH2CH2CHO+O2$→_{△}^{催化剂}$2(CH3)2CH2CH2COOH.
;B→C的化学方程式为2(CH3)2CH2CH2CHO+O2$→_{△}^{催化剂}$2(CH3)2CH2CH2COOH.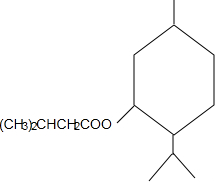 .
.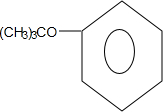 .
.
 .
.