题目内容
9.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 1 mol二甲醚中含有的C-O键的数目为2NA | |
| B. | 标准状况下,44.8 L四氯化碳中含有分子的数目为2NA | |
| C. | 200 g质量分数为23%的HCOOH水溶液中含氧原子的总数目为2NA | |
| D. | 在反应Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,每生成1 molCu,转移电子的数目为2NA |
分析 A、二甲醚的结构简式为CH3OCH3,据此分析;
B、标况下,四氯化碳为液态;
C、200g质量分数为23%的甲醛溶液中,除了甲醛含有氧原子,水也含氧原子;
D、在此反应中,每生成1mol铜,转移3mol电子.
解答 解:A、二甲醚的结构简式为CH3OCH3,则1mol二甲醚中含2molC-O键,即2NA条,故A正确;
B、标况下,四氯化碳为液态,不能根据气体摩尔体积来计算,故B错误;
C、200g质量分数为23%的甲醛溶液中,除了甲醛含有氧原子,水也含氧原子,故溶液中所含的氧原子的物质的量大于2mol,即大于2NA个,故C错误;
D、在此反应中,铜元素的化合价降低,S元素的化合价升高,氧元素的化合价降低,即Cu2S既做氧化剂又做还原剂,氧气做氧化剂,每生成1mol铜,转移3mol电子,即转移3NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
19.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色.五种元素核电荷数之和为54,最外层电子数之和为20.W、Z最外层电子数相同,Z的核电荷数是W的2倍.工业上一般通过电解氧化物的方法获得Y的单质.则下列说法不正确的是( )
| A. | 原子半径:X>Y>Q>W | |
| B. | Q和Z所形成的分子空间构型为直线形 | |
| C. | Q和W可形成原子个数比为1:1和2:1的常见化合物 | |
| D. | X、Y和W三种元素形成的化合物的水溶液呈碱性 |
20.下列叙述中正确的是( )
| A. | 25℃,Cu(OH)2在水中的溶度积比其在Cu(NO3)2溶液中的大 | |
| B. | 氨水溶液加水稀释,电离程度增大,c(OH-)增大 | |
| C. | 25℃,为使100mlpH=2的醋酸溶液pH变为3,可加入900ml 水 | |
| D. | CH3COONa溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
4. 2015年2月美国研究人员将CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K,成功观察到CO与O形成化学键生成CO2的全过程.下列说法正确的是( )
2015年2月美国研究人员将CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K,成功观察到CO与O形成化学键生成CO2的全过程.下列说法正确的是( )
 2015年2月美国研究人员将CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K,成功观察到CO与O形成化学键生成CO2的全过程.下列说法正确的是( )
2015年2月美国研究人员将CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K,成功观察到CO与O形成化学键生成CO2的全过程.下列说法正确的是( )| A. | CO、CO2均属于酸性氧化物 | |
| B. | 形成化学键时需吸收能量 | |
| C. | 钌催化剂可以改变该反应的焓变 | |
| D. | CO与O形成化学键过程中有电子转移 |
14.青藤碱具有祛风寒湿、活血止痛的功效,其结构简式如图所示,下列说法正确的是( )

| A. | 每个青藤碱分子中含有2个手性碳原子 | |
| B. | 1 mol青藤碱最多能与1 mol Br2发生反应 | |
| C. | 1 mol青藤碱最多能与4 mol H2发生反应 | |
| D. | 青藤碱既能与盐酸反应又能与NaOH溶液反应 |
15.下列说法正确的是( )
| A. | 自来水厂常用液氯给自来水消毒,主要是因为Cl2具有强氧化性 | |
| B. | 限制大排量汽车,也是防止酸雨的重要途径 | |
| C. | 镀金的钢铁器件既能增加美观,又可以在即使镀层局部破损后防止器件的损耗 | |
| D. | 乙醇可以发生的反应类型有:取代反应、消去反应、加成反应 |
16.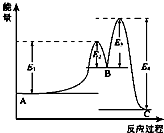 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | 两步反应均为吸热反应 | B. | 加入催化剂会改变反应的焓变 | ||
| C. | 三种化合物中C最稳定 | D. | 整个反应中△H=E1-E4 |

 ,反应类型为酯化反应;
,反应类型为酯化反应; ,反应5除生成氯吡格雷外,另一种产物的名称是HOCH2CH2OH;
,反应5除生成氯吡格雷外,另一种产物的名称是HOCH2CH2OH; ③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按官能团的不同可分为( )
③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按官能团的不同可分为( )