题目内容
11.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,不一定能产生沉淀的是( )| 序号 | 甲 | 乙 | 丙 |
| A | CO2 | SO2 | 澄清石灰水 |
| B | HCl | CO2 | Ba(OH)2 |
| C | CO2 | SO2 | Ba(NO3)2 |
| D | CO2 | NH3 | CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫和二氧化碳都和澄清石灰水反应生成白色沉淀;
B.盐酸酸性大于碳酸,盐酸和氢氧化钡反应生成氯化钡和水;
C.二氧化硫能被氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;
D.氨气、二氧化碳和水反应生成碳酸铵,碳酸铵和氯化钙发生复分解反应.
解答 解:A.二氧化硫和二氧化碳都和澄清石灰水反应生成白色沉淀,所以一定有白色沉淀产生,故A不选;
B.氢氧化钡过量,不管HCl的量和二氧化碳的量是多少,都产生白色沉淀,故B不选;
C.二氧化硫能被氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀,所以一定产生白色沉淀,故C不选;
D.如果二氧化碳很多,氨气很少,可能生成碳酸氢钙溶液,不一定有沉淀,故D选;
故选D.
点评 本题考查物质之间的反应,明确物质的性质及酸的书写强弱是解本题关键,注意C中二氧化硫和硝酸根离子发生氧化还原反应,为易错点.

练习册系列答案
相关题目
19.Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色.五种元素核电荷数之和为54,最外层电子数之和为20.W、Z最外层电子数相同,Z的核电荷数是W的2倍.工业上一般通过电解氧化物的方法获得Y的单质.则下列说法不正确的是( )
| A. | 原子半径:X>Y>Q>W | |
| B. | Q和Z所形成的分子空间构型为直线形 | |
| C. | Q和W可形成原子个数比为1:1和2:1的常见化合物 | |
| D. | X、Y和W三种元素形成的化合物的水溶液呈碱性 |
6.元素的原子结构决定其性质和在周期表中的位置.下列说法正确的是( )
| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离原子核较近的区域内运动的电子能量较高 | |
| C. | P、S、Cl非金属性和最高价氧化物对应的水化物的酸性均依次增强 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
16.下列离子方程式书写正确的一项是( )
| A. | 向Na2S2O3溶液中通入足量Cl2:S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+ | |
| B. | 向苯酚钠溶液中通入少量的CO2:CO2+2C6H5O-+H2O═2C6H5OH+CO32- | |
| C. | 草酸加入硫酸酸化的高锰酸钾溶液中:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O | |
| D. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+CO32- |
3.下列各组离子在指定分散系中一定能大量共存的是( )
| A. | 明矾溶液中:Na+、Mg2+、NO3-、HCO3- | |
| B. | 澄清透明的溶液中:Na+、K+、MnO4-、ClO- | |
| C. | pH=0的溶液中:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、SO32- |
20.下列叙述中正确的是( )
| A. | 25℃,Cu(OH)2在水中的溶度积比其在Cu(NO3)2溶液中的大 | |
| B. | 氨水溶液加水稀释,电离程度增大,c(OH-)增大 | |
| C. | 25℃,为使100mlpH=2的醋酸溶液pH变为3,可加入900ml 水 | |
| D. | CH3COONa溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
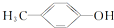 ③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按官能团的不同可分为( )
③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按官能团的不同可分为( )