题目内容
6.某无机化合物A的相对分子质量为184,在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7.将18.4gA隔绝空气加强热可得到12.8g B和气体单质C.请回答下列问题:(1)A的化学式为S4N4,C的电子式为
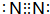 .
.(2)写出SCl2与氨反应的化学方程式:6SCl2+16NH3$\frac{\underline{\;一定条件下\;}}{\;}$S4N4+2S+12NH4Cl.
(3)亚硝酸钠和X固体在加热条件下可能(填“可能”或“不能”)发生反应,判断理由是NaNO2中N元素化合价为+3价,NH4Cl中N元素化合价为-3价,发生氧化还原反应生成N2.
(4)请设计检验物质X的实验方案:取少量X固体加水溶解,分成两份;其中一份加入浓NaOH溶液加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则证明有NH4+;向另一份溶液中加入硝酸酸化的AgNO3溶液,若出现白色沉淀,则证明有Cl-.
分析 X的水溶液的pH<7,则X为强酸弱碱盐,在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,根据元素守恒知淡黄色单质B为S、X为NH4Cl,某无机化合物A的相对分子质量为184,18.4gA的物质的量=$\frac{18.4g}{184g/mol}$=0.1mol,根据质量守恒定律得C质量为18.4g-12.8g=5.6g,A分解生成S和单质C,则A是二元化合物且含有S元素,SCl2与氨反应生成NH4Cl,氨气中N、H原子个数比为1:3、氯化铵中N、H原子个数比为1:4,根据原子守恒知,A中还含有N元素,所以C为N2,n(S)=$\frac{12.8g}{32g/mol}$=0.4mol、n(S)=$\frac{5.6g}{14g/mol}$=0.4mol,所以A中N、S原子个数之比为0.4mol:0.4mol=1:1,所以A为S4N4,
据此分析解答.
解答 解:(1)通过以上分析知,A的化学式为S4N4,C是氮气,其电子式为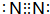 ,故答案为:S4N4;
,故答案为:S4N4; ;
;
(2)一定条件下,SCl2与氨反应生成S、氯化铵和S4N4,反应方程式为6SCl2+16NH3$\frac{\underline{\;一定条件下\;}}{\;}$S4N4+2S+12NH4Cl,
故答案为:6SCl2+16NH3$\frac{\underline{\;一定条件下\;}}{\;}$S4N4+2S+12NH4Cl;
(3)亚硝酸钠中N元素化合价为+3价、氯化铵中N元素化合价为-3价,二者可以发生氧化还原反应生成0价的氮气,故答案为:可能;NaNO2中N元素化合价为+3价,NH4Cl中N元素化合价为-3价,发生氧化还原反应生成N2;
(4)X为氯化铵,氯离子可以用硝酸酸化的硝酸银检验,铵根离子可以用NaOH、湿润的红色石蕊试纸检验,其检验方法是:取少量X固体加水溶解,分成两份;其中一份加入浓NaOH溶液加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则证明有NH4+;向另一份溶液中加入硝酸酸化的AgNO3溶液,若出现白色沉淀,则证明有Cl-,
故答案为:取少量X固体加水溶解,分成两份;其中一份加入浓NaOH溶液加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则证明有NH4+;向另一份溶液中加入硝酸酸化的AgNO3溶液,若出现白色沉淀,则证明有Cl-.
点评 本题考查无机物推断,涉及S、N元素及其化合物之间的转化,根据氨气与SCl2反应前后N、H元素原子个数比确定A是解本题关键,熟悉常见离子的检验方法,易错点是化学用语的灵活运用,题目难度中等.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 聚丙烯的结构简式: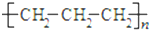 | |
| B. | 乙炔的分子结构模型示意图: | |
| C. | H2O2的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| D. |  的名称:3-甲基-1-丁醇 的名称:3-甲基-1-丁醇 |
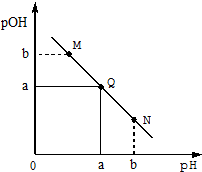 某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列
某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列说法错误的是( )
| A. | Q点消耗氨水溶液的体积等于HCl溶液的体积 | |
| B. | M点所示溶液导电能力弱于Q点 | |
| C. | M点和N点所示溶液中水的电离程度相同 | |
| D. | N点所示溶液中c(NH4+)>c(OH-) |
| A. | 0.1 mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO32-)+c(HCO3-)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO32-)>c(HCO3-) | |
| D. | 0.2 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
| A. | 重金属离子Ag+、Cu2+、K+均可导致蛋白质变性 | |
| B. | S02和NxOy都属于非金属氧化物,也都是酸性氧化物 | |
| C. | 部分颗粒分散在空气中可能会形成丁达尔现象 | |
| D. | 苯和苯的衍生物都是芳香烃 |

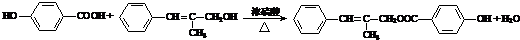 .
. .
. (其中任一种).
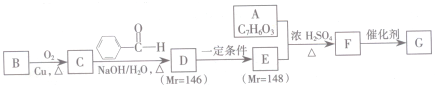
(其中任一种).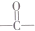 结构②苯环上有2个取代基.
结构②苯环上有2个取代基. 某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4.回答下列问题:
某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4.回答下列问题: