题目内容
16.已知N2O4(无色)?2NO2(红棕色),某温度时1molN2O4气体通入体积为10L的真空密闭容器中,立即出现红棕色,反应进行4s时NO2的浓度为0.04mol•L-1,再经过时间t后,这时容器内的压强为开始时的1.8倍.则:(1)前4s内以N2O4的浓度变化表示的平均反应速率为0.005mol/(L.s).
(2)在4s时容器内的压强为开始时的1.2倍.
(3)在t时容器内含NO21.6mol.
分析 (1)根据v=$\frac{△c}{△t}$计算v(NO2),再利用速率之比等于其化学计量数之比计算v(N2O4);
(2)根据n=cV计算4s时NO2的物质的量,结合方程式计算参加反应四氧化二氮的物质的量,进而计算4s时混合气体总物质的量,恒温恒容下,气体压强之比等于其物质的量之比;
(3)恒温恒容下,气体压强之比等于其物质的量之比,据此计算t时后混合气体总物质的量,根据方程式利用差量法计算二氧化氮的物质的量.
解答 解:(1)4s时NO2的浓度为0.04mol•L-1,则v(NO2)=$\frac{0.04mol/L}{4s}$=0.01mol/(L.s),速率之比等于其化学计量数之比,则v(N2O4)=$\frac{1}{2}$v(NO2)=$\frac{1}{2}$×0.01mol/(L.s)=0.005mol/(L.s),
故答案为:0.005mol/(L.s);
(2)4s时NO2的物质的量为10L×0.04mol•L-1=0.4mol,则参加反应N2O4的物质的量为0.4mol×$\frac{1}{2}$=0.2mol,故4s时混合气体总物质的量为(1mol-0.2mol)+0.4mol=1.2mol,恒温恒容下,气体压强之比等于其物质的量之比,故4s时容器内的压强为开始时的$\frac{1.2mol}{1mol}$=1.2倍,
故答案为:1.2;
(3)恒温恒容下,气体压强之比等于其物质的量之比,则t时后混合气体总物质的量为1mol×1.8=1.8mol,设二氧化氮的物质的量为x,则:
N2O4(无色)?2NO2(红棕色)物质的量增大
2 1
x 1.8mol-1mol=0.8mol
故x=$\frac{0.8mol×2}{1}$=1.6mol
故答案为:1.6.
点评 本题考查化学反应速率计算、化学平衡有关计算,难度不大,有利于基础知识的巩固.


| A. | 金刚石比石墨稳定性好 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| D. | 断裂1 mol石墨中的化学键吸收的能量比断裂1 mol金刚石中的化学键吸收的能量小1.9 kJ |
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A. | K、L、M三种元素的金属性逐渐减弱 | |
| B. | 在RCl2分子中,各原子均满足8电子的稳定结构 | |
| C. | Q元素的最高价氧化物为非电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键 |
| A. | 普通的食醋中含3%~5%(质量分数)的乙酸 | |
| B. | 醋酸是一种弱酸,其酸性比碳酸更弱 | |
| C. | 可以用醋除去烧开水的壶内壁的水垢 | |
| D. | 在一定条件下,乙酸能与乙醇发生酯化反应 |
 当今世界,能源的发展日益成为全世界、全人类共同关心的问题.
当今世界,能源的发展日益成为全世界、全人类共同关心的问题.(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 899 | 1 757 | 14 840 | 21 000 |
| B | 738 | 1 451 | 7 733 | 10 540 |
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中碳碳键的键长为154.45pm,C60中碳碳键的键长为145pm和140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由否或不正确,理由:C60是分子晶体,金刚石是原子晶体,熔化时C60破坏分子间作用力而金刚石破坏共价键,所以C60的沸点低于金刚石.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.
③继C60后,科学家又合成Si60、N60,请比较C、Si、N原子电负性由大到小的顺序N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中所含π键的数目为30.
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与过量稀硝酸反应:Fe3O4+8H+→2Fe3++Fe2++4H2O | 正确 |
| B | 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液: 2Fe3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Fe(OH)3↓ | 正确 |
| C | 在稀氨水中通入过量CO2:NH3•H2O+CO2→NH4++HCO3- | 正确 |
| D | FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2→2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的化学计量数之比应为1:2 |
| A. | A | B. | B | C. | C | D. | D |
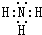 ,A在周期表中的位置第一周期第ⅠA族.
,A在周期表中的位置第一周期第ⅠA族.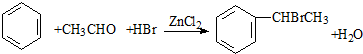 (卤烷基化反应)
(卤烷基化反应)
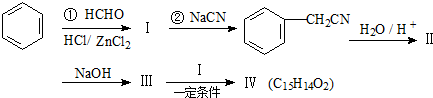
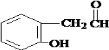 ,
,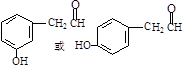 .
.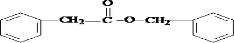 .
.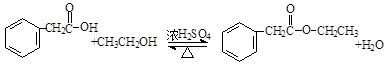 .
.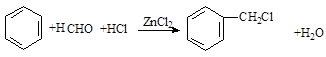 .
.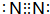 .
.