题目内容
11.下列溶液中有关物质的量浓度关系正确的是( )| A. | 0.1 mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO32-)+c(HCO3-)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO32-)>c(HCO3-) | |
| D. | 0.2 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
分析 A.NaHCO3溶液呈碱性,HCO3-水解程度大于电离程度;
B、0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合,恰好完全反应生成单一的碳酸钠;
C、向0.1mol•L-1NaHCO3溶液中加入等体积0.2 mol•L-1NaOH溶液后,相当于0.05 mol•L-1的Na2CO3溶液和0.05 mol•L-1NaOH溶液的混合液,由于Na2CO3的水解,导致氢氧根离子浓度大于0.05 mol•L-1,而碳酸根离子浓度小于0.05 mol•L-1;
D、向0.2mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液后,相当于0.05 mol•L-1的Na2CO3溶液和0.05 mol•L-1NaHCO3溶液的混合液,根据物料守恒和电荷守恒分析解答.
解答 解:A.NaHCO3溶液呈碱性,HCO3-水解程度大于电离程度,则c(H2CO3)>c(CO32-),故A错误;
B.Na2CO3溶液中存在物料守恒,为c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故B错误;
C、向0.1mol•L-1NaHCO3溶液中加入等体积0.2 mol•L-1NaOH溶液后,相当于0.05 mol•L-1的Na2CO3溶液和0.05 mol•L-1NaOH溶液的混合液,由于Na2CO3的水解呈碱性,所以c(Na+)>c(OH-)>0.05 mol•L-1>c(CO32-)>c(HCO3-),故C正确;
D、向0.2mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液后,相当于0.05 mol•L-1的Na2CO3溶液和0.05 mol•L-1NaHCO3溶液的混合液,根据电荷守恒可知:c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-)-c(H+).…①,而物料守恒可知:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)…②,将①代入②,可得:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+),故D正确;
故选:CD.
点评 本题考查离子浓度大小的比较,结合盐的水解综合分析离子浓度的变化情况,学生要学会将守恒知识在解这类题中的应用,有一定的难度.

 快捷英语周周练系列答案
快捷英语周周练系列答案| A. | 普通的食醋中含3%~5%(质量分数)的乙酸 | |
| B. | 醋酸是一种弱酸,其酸性比碳酸更弱 | |
| C. | 可以用醋除去烧开水的壶内壁的水垢 | |
| D. | 在一定条件下,乙酸能与乙醇发生酯化反应 |
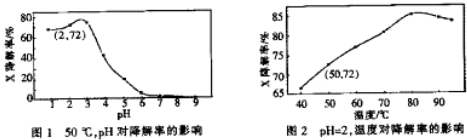
| A. | 温度为50℃,pH在3~6之间,X降解率随pH增大而减小 | |
| B. | pH=2,温度在40~80℃,X降解率温度升高而增大 | |
| C. | 无需再进行后续实验,就可以判断最佳反应条件是:pH=3、温度为80℃ | |
| D. | pH=2,温度为50℃,10min内v(X)=1.44×10-4 mol•L-1 min-1 |
| A. | 反应后生成NO的体积为28 L | B. | 所得溶液中的溶质只有FeSO4 | ||
| C. | 所得溶液中c(NO3-)=2.75 mol.L-1 | D. | 所得溶液中c(Fe2+):c(Fe3+ )=1:1 |
| A. | C6H5OH | B. | H2O | C. | HNO3 | D. | C2H5OH |
 .
.