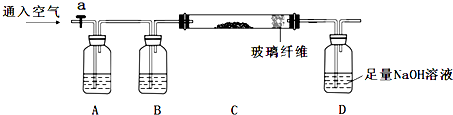
题目内容
18.在实验室里,取4.6gNa与足量T2O(T:${\;}_{1}^{3}$H)充分反应,求:(1)在标准状况下,可以收集到多少升的气体?
(2)在标准状况下,收集到的气体中含有多少个中子?
分析 (1)先根据钠与T2O反应求出氢氧化钠,求气体的体积;
(2)结合气体的物质的量,根据1molT2中含有4mol的中子,来分析求解.
解答 解:(1)2Na+2T2O=2NaOT+T2↑
46g 22.4L
4.6g V
所以V=2.24L,
答:在标准状况下,可以收集到2.24L的气体;
(2)n(T2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,所以含有0.1×4×NA中子,所以0.4NA,答:收集到的气体中含有0.4NA中子.
点评 本题考查根据方程式的有关计算,难度不大,关键是计算T2中的中子数是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8. 当今世界,能源的发展日益成为全世界、全人类共同关心的问题.
当今世界,能源的发展日益成为全世界、全人类共同关心的问题.
(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
①请根据上述信息,写出A的核外电子排布式:1s22s2.
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中碳碳键的键长为154.45pm,C60中碳碳键的键长为145pm和140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由否或不正确,理由:C60是分子晶体,金刚石是原子晶体,熔化时C60破坏分子间作用力而金刚石破坏共价键,所以C60的沸点低于金刚石.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.
③继C60后,科学家又合成Si60、N60,请比较C、Si、N原子电负性由大到小的顺序N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中所含π键的数目为30.
 当今世界,能源的发展日益成为全世界、全人类共同关心的问题.
当今世界,能源的发展日益成为全世界、全人类共同关心的问题.(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 899 | 1 757 | 14 840 | 21 000 |
| B | 738 | 1 451 | 7 733 | 10 540 |
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中碳碳键的键长为154.45pm,C60中碳碳键的键长为145pm和140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由否或不正确,理由:C60是分子晶体,金刚石是原子晶体,熔化时C60破坏分子间作用力而金刚石破坏共价键,所以C60的沸点低于金刚石.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.
③继C60后,科学家又合成Si60、N60,请比较C、Si、N原子电负性由大到小的顺序N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中所含π键的数目为30.
9.A、B、C、D、E是中学化学中五种常见元素,有关信息如表:
请回答下列问题:
(1)A的氢化物分子式是NH3,其水溶液能使酚酞变红的原因(用电离方程式解释)为:NH3•H2O?NH4++OH-;
(2)A、D的氢化物相互反应,产生大量白烟,该反应的方程式为:NH3+HCl=NH4Cl;
(3)A与B可组成质量比为7:16的三原子分子,该分子的化学式为NO2.
| 元素 | 有关信息 |
| A | 其氢化物水溶液呈碱性 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子式是NH3,其水溶液能使酚酞变红的原因(用电离方程式解释)为:NH3•H2O?NH4++OH-;
(2)A、D的氢化物相互反应,产生大量白烟,该反应的方程式为:NH3+HCl=NH4Cl;
(3)A与B可组成质量比为7:16的三原子分子,该分子的化学式为NO2.
13.分子式为C6H14O的醇中,有些醇能被氧化成相应的酸,这些醇与相应的酸重新组合可形成的脂共有( )
| A. | 16种 | B. | 25种 | C. | 36种 | D. | 64种 |
10.铜有两种天然同位素,则${\;}_{29}^{63}$Cu+和${\;}_{29}^{65}$Cu具有相同的( )
| A. | 质量数 | B. | 中子数 | C. | 核电荷数 | D. | 能层和能级 |
7.消除氮氧化物和硫氧化物有多种方法.
Ⅰ.NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图1所示:
①由图可知SCR技术中的氧化剂为NO、NO2.
②用Fe做催化剂时,在氨气足量的情况下,当$\frac{c(N{O}_{2})}{c(NO)}$=1:1时,脱氮率最佳,已知每生成28g N2 放出的热量为QkJ,该反应的热化学方程式为2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol.
Ⅱ.工业上变“废”为宝,吸收工业中SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如图2(Ce为铈元素):
①装置Ⅰ中的主要反应的离子方程式为SO2+OH-=HSO3-.
②装置Ⅲ还可以使Ce4+再生,若用甲烷燃料电池电解该装置中的溶液,当消耗1mol CH4时,理论上可再生8mol Ce4+.
Ⅲ.用活性炭还原法可以处理氮氧化物.如发生反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ/mol.
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①Tl℃时,该反应的平衡常数K=$\frac{9}{16}$.
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的CO2和N2(答一种即可).
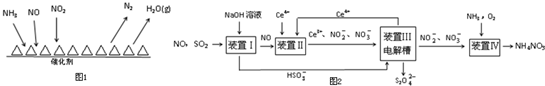
Ⅰ.NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图1所示:
①由图可知SCR技术中的氧化剂为NO、NO2.
②用Fe做催化剂时,在氨气足量的情况下,当$\frac{c(N{O}_{2})}{c(NO)}$=1:1时,脱氮率最佳,已知每生成28g N2 放出的热量为QkJ,该反应的热化学方程式为2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol.
Ⅱ.工业上变“废”为宝,吸收工业中SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如图2(Ce为铈元素):
①装置Ⅰ中的主要反应的离子方程式为SO2+OH-=HSO3-.
②装置Ⅲ还可以使Ce4+再生,若用甲烷燃料电池电解该装置中的溶液,当消耗1mol CH4时,理论上可再生8mol Ce4+.
Ⅲ.用活性炭还原法可以处理氮氧化物.如发生反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ/mol.
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的CO2和N2(答一种即可).

14.过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至350℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2,过氧化钙可用于改善水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等,是一种重要化工试剂.
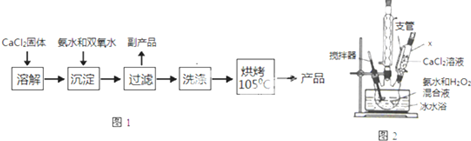
(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图1,反应装置如图2所示,请回答下列问题:
(1)仪器x的名称为恒压滴液漏斗(或恒压分液漏斗)
(2)用平衡移动原理解释加入氨水的作用是中和反应生成的HCl,使CaCl2+H2O2?CaO2+2HCl向右进行.
(3)沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是减少双氧水受热分解、降低产物溶解度便于析出(写出两种)
(4)过滤后洗涤沉淀的试剂最好用B
A.热水 B.冷水 C.乙醇 D.乙醚
(Ⅱ)CaO2纯度检测,将一定量CaO2溶于稀硫酸,用标准KMnO4溶于滴定生成的H2O2(KMnO4反应后生成Mn2+)计算确定CaO2的含量.
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定所得数据如表所示,则CaO2样品的纯度90.00%
(6)测得CaO2纯度偏低的原因可能是AD
A.烘烤时间不足
B.在洁净干燥的酸式滴定管中未润洗即装标准液
C.滴定前尖嘴处有气泡.滴定后消失
D.配置KMnO4标准溶液定容时俯视容量瓶标线.

(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图1,反应装置如图2所示,请回答下列问题:
(1)仪器x的名称为恒压滴液漏斗(或恒压分液漏斗)
(2)用平衡移动原理解释加入氨水的作用是中和反应生成的HCl,使CaCl2+H2O2?CaO2+2HCl向右进行.
(3)沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是减少双氧水受热分解、降低产物溶解度便于析出(写出两种)
(4)过滤后洗涤沉淀的试剂最好用B
A.热水 B.冷水 C.乙醇 D.乙醚
(Ⅱ)CaO2纯度检测,将一定量CaO2溶于稀硫酸,用标准KMnO4溶于滴定生成的H2O2(KMnO4反应后生成Mn2+)计算确定CaO2的含量.
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定所得数据如表所示,则CaO2样品的纯度90.00%
| 实验序号 | 第1次 | 第2次 | 第3次 | 第4次 |
| 消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
A.烘烤时间不足
B.在洁净干燥的酸式滴定管中未润洗即装标准液
C.滴定前尖嘴处有气泡.滴定后消失
D.配置KMnO4标准溶液定容时俯视容量瓶标线.
 .
.