题目内容
4.乙酰苯胺可用作止痛剂、退热剂、防腐剂和染料中间体,实验室制备乙酰苯胺反应原理和有关数据如下: NH2+CHCOOH$\stackrel{△}{?}$
NH2+CHCOOH$\stackrel{△}{?}$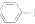
 +H2O
+H2O| 名称 | 相对分子质量 | 性状 | 密度/(g/cm3) | 熔点/℃ | 沸点/℃ | 溶解度 | |
| 苯胺 | 93 | 无色油状液体具有还原性 | 1.02 | -6.1 | 184 | 微溶于水 | 均易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 16.5 | 118 | 易溶于水 | |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 114 | 304 | 微溶于冷水,溶于热水 | |
在50ml圆底烧瓶中加入无水苯胺5ml.,冰醋酸7.5mL,锌粉0.lg,按下图安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,调节加热温度,使柱顶温度控制在105℃左右,反应约60~80nun,当反应基本完成时,停止加热.
在搅拌下,趁热将烧瓶中的物料倒人盛有l00mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品.将粗品重结晶,抽滤,晾干,称重,计算产率,
注:D为刺形分馏柱,用于沸点差别不太大的混合物的分离.
 ,
,请回答下列问题:
(1)仪器A的名称冷凝管,
(2)装置图中加热可用油浴(填“水浴”或“油浴”).
(3)实验中加入锌粉的目的是防止苯胺在反应过程中被氧化.
(4)为何要控制分馏柱上端的温度在105℃左右不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(5)通过观察到温度计温度下降或锥形瓶内液体不再增加,现象可判断反应基本完成,反应结束后须立即倒入事先准备好的冰水中的原因乙酰苯胺的熔点较高,稍冷即会固化,凝固在烧瓶中难易倒出.
(6)洗涤乙酰苯胺粗品最合适的试剂是a.
a.用少量冷水洗 b.用少量热水洗c.先用冷水洗,再用热水洗 d.用酒精洗
(7)该实验最终得到纯品1.8g,则乙酰苯胺的产率是24%.
分析 (1)仪器A为冷凝管;
(2)由于反应控制温度在105℃左右,而沸腾的水温度为100℃,不能达到该温度,所以可用油浴加热的方法;
(3)苯胺不稳定,容易被空气中的氧气氧化为硝基苯,为防止苯胺在反应过程中被氧化,需要加入还原剂Zn粉;
(4)水的沸点是100℃,加热至105℃左右,就可以不断分出反应过程中生成的水,促进反应正向进行;
(5)根据温度计温度下降或锥形瓶内液体不再增加可以判断反应基本完成;
乙酰苯胺的熔点较高,稍冷即会固化,凝固在烧瓶中难易倒出;
(6)洗涤粗产品注意减少因溶解造成的损耗,结合产品的溶解性判断,
(7)计算苯胺、乙酸的物质的量,判断反应物过量问题,根据不足量的物质计算乙酰苯胺的理论产量,进而计算乙酰苯胺的产率.
解答 解:(1)由仪器的结构特征,控制仪器A为冷凝管,故答案为:冷凝管;
(2)由于反应控制温度在105℃左右,而沸腾的水温度为100℃,不能达到该温度,所以可用油浴加热的方法,故答案为:油浴;
(3)苯胺不稳定,容易被空气中的氧气氧化为硝基苯,加入还原剂Zn粉,可以防止苯胺在反应过程中被氧化,故答案为:防止苯胺在反应过程中被氧化;
(4)水的沸点是100℃,加热至105℃左右,就可以不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率,故答案为:不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率;
(5)若看到温度计温度下降或锥形瓶内液体不再增加,就表明反应物的蒸气较少,生成物达到了最大量,反应基本完成;
由于乙酰苯胺的熔点较高,稍冷即会固化,凝固在烧瓶中难易倒出,反应结束后须立即倒入事先准备好的冰水中,
故答案为:温度计温度下降或锥形瓶内液体不再增加;乙酰苯胺的熔点较高,稍冷即会固化,凝固在烧瓶中难易倒出;
(6)由于乙酰苯胺微溶于冷水,溶于热水,易溶于乙醇、乙醚,所以洗涤粗品最合适的试剂是用少量冷水洗,以减少因洗涤造成的损耗,故选:A;
(7)n(苯胺)=(5mL×1.02g/mL)÷93g/mol=0.055mol,n(乙酸)=( 7.5mL×1.05g/ml)÷60g/mol=0.13mol,二者按1:1反应,由于乙酸的物质的量大于苯胺的物质的量,所以产生乙酰苯胺的物质的量要以不足量的苯胺为原料为标准,乙酰苯胺的理论产量为0.055mol,而实际产量n(乙酰苯胺)=1.8g÷135g/mol=0.0133mol,所以乙酰苯胺的产率为(0.0133mol÷0.055mol)×100%=24%,
故答案为:24%.
点评 本题考查有机物的合成实验、基本操作、实验条件的控制与分析评价等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案| A. | 通入Ne | B. | 通入NO2 | C. | 通入N2O4 | D. | 以上都不行 |
| A. | 只有放热的氧化还原反应才能设计成原电池,并将电能转化为化学能 | |
| B. | 电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路 | |
| C. | 无论在原电池还是在电解池中,电子均不能通过电解质溶液 | |
| D. | 原电池的负极失去电子的总数等于正极得到电子的总数 |
| A. | 85L | B. | 75L | C. | 73L | D. | 70L |
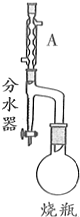 实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
| 药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(g•cm-3) |
| 甲醇 | 32 | -98 | -64.5 | 与水混溶,易溶于有机溶剂 | 0.79 |
| 甲基丙烯酸 | 86 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 |
| 甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 |
向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;按图示连接装置加热烧瓶中混合液,通过分水器分离出水,用锥形瓶盛接收集产生的水;当不再有水生成,停止加热;冷却后用试剂X洗涤烧瓶中的混合溶液并分离;取有机层混合液减压蒸馏,得到较纯净的甲基丙烯酸甲酯.请回答下列问题:
(1)A装置的名称是球形冷凝管.
(2)上述实验中浓硫酸有提高甲基丙烯酸甲酯产率的作用,其原理浓硫酸吸收产物水,能使酯化反应向正方向移动.但是浓硫酸过多,产率降低,原因是浓硫酸具有强氧化性,能氧化有机反应物.
(3)上述实验可能生成的副产物结构简式为CH3OCH3(填一种即可)
(4)试剂X宜选择c.
a.饱和食盐水 b.氢氧化钠溶液 c.饱和碳酸钠溶液
(5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为85.2%.实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是c.
a.分水器收集的水里含甲酯
b.实验条件下发生副反应
c.产品精制时收集部分低沸点物质
d.产品在洗涤、蒸发过程中有损失.
| A. | 利用以下实验器材(规格和数量不限):烧杯、玻璃棒、胶头滴管、分液漏斗,能完成用溴水和CCl4除去NaBr溶液中的少量NaI的实验 | |
| B. | 制备硫酸亚铁晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液被全部蒸干 | |
| C. | 向两支盛有KI3溶液的试管中分别加入淀粉和硝酸银溶液,前者溶液变蓝后者产生黄色沉淀,由此得出KI3溶液中存在平衡I3-?I2+I- | |
| D. | 科学家在研究物质微观结构的过程中先后使用了光学显微镜、电子显微镜、扫描隧道显微镜等观测仪器 |
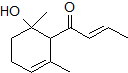 ,可用于制作香水.有关该化合物的下列说法正确的是( )
,可用于制作香水.有关该化合物的下列说法正确的是( )| A. | 分子式为C12H20O2 | B. | 该化合物可使酸性KMnO4溶液褪色 | ||
| C. | 该化合物可与NaOH溶液发生反应 | D. | 1 mol该化合物可与2 mol Br2加成 |
 ,
,