题目内容
14.一种从植物中提取的天然化合物,其结构为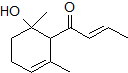 ,可用于制作香水.有关该化合物的下列说法正确的是( )
,可用于制作香水.有关该化合物的下列说法正确的是( )| A. | 分子式为C12H20O2 | B. | 该化合物可使酸性KMnO4溶液褪色 | ||
| C. | 该化合物可与NaOH溶液发生反应 | D. | 1 mol该化合物可与2 mol Br2加成 |
分析 由结构简式可知分子式,分子含含-OH、C=O、C=C,结合醇、烯烃、酮的性质来解答.
解答 解:A.由结构可知,分子式为C12H18O2,故A错误;
B.含碳碳双键,则该化合物可使酸性KMnO4溶液褪色,故B正确;
C.含有羟基和羰基,与氢氧化钠不反应,故C错误;
D.1mol该有机物含2mol碳碳双键,则1 mol该化合物可与2 mol Br2加成,故D正确;
故选BD.
点评 本题考查有机物的结构与性质,为高考常见题型,把握官能团与性质的关系为解答的关键,注意燃烧通式的利用及烯烃性质即可解答,题目难度不大.

练习册系列答案
相关题目
4.乙酰苯胺可用作止痛剂、退热剂、防腐剂和染料中间体,实验室制备乙酰苯胺反应原理和有关数据如下: NH2+CHCOOH$\stackrel{△}{?}$
NH2+CHCOOH$\stackrel{△}{?}$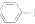
 +H2O
+H2O
实验步骤:
在50ml圆底烧瓶中加入无水苯胺5ml.,冰醋酸7.5mL,锌粉0.lg,按下图安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,调节加热温度,使柱顶温度控制在105℃左右,反应约60~80nun,当反应基本完成时,停止加热.
在搅拌下,趁热将烧瓶中的物料倒人盛有l00mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品.将粗品重结晶,抽滤,晾干,称重,计算产率,
注:D为刺形分馏柱,用于沸点差别不太大的混合物的分离. ,
,
请回答下列问题:
(1)仪器A的名称冷凝管,
(2)装置图中加热可用油浴(填“水浴”或“油浴”).
(3)实验中加入锌粉的目的是防止苯胺在反应过程中被氧化.
(4)为何要控制分馏柱上端的温度在105℃左右不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(5)通过观察到温度计温度下降或锥形瓶内液体不再增加,现象可判断反应基本完成,反应结束后须立即倒入事先准备好的冰水中的原因乙酰苯胺的熔点较高,稍冷即会固化,凝固在烧瓶中难易倒出.
(6)洗涤乙酰苯胺粗品最合适的试剂是a.
a.用少量冷水洗 b.用少量热水洗c.先用冷水洗,再用热水洗 d.用酒精洗
(7)该实验最终得到纯品1.8g,则乙酰苯胺的产率是24%.
 NH2+CHCOOH$\stackrel{△}{?}$
NH2+CHCOOH$\stackrel{△}{?}$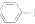
 +H2O
+H2O| 名称 | 相对分子质量 | 性状 | 密度/(g/cm3) | 熔点/℃ | 沸点/℃ | 溶解度 | |
| 苯胺 | 93 | 无色油状液体具有还原性 | 1.02 | -6.1 | 184 | 微溶于水 | 均易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 16.5 | 118 | 易溶于水 | |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 114 | 304 | 微溶于冷水,溶于热水 | |
在50ml圆底烧瓶中加入无水苯胺5ml.,冰醋酸7.5mL,锌粉0.lg,按下图安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,调节加热温度,使柱顶温度控制在105℃左右,反应约60~80nun,当反应基本完成时,停止加热.
在搅拌下,趁热将烧瓶中的物料倒人盛有l00mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品.将粗品重结晶,抽滤,晾干,称重,计算产率,
注:D为刺形分馏柱,用于沸点差别不太大的混合物的分离.
 ,
,请回答下列问题:
(1)仪器A的名称冷凝管,
(2)装置图中加热可用油浴(填“水浴”或“油浴”).
(3)实验中加入锌粉的目的是防止苯胺在反应过程中被氧化.
(4)为何要控制分馏柱上端的温度在105℃左右不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(5)通过观察到温度计温度下降或锥形瓶内液体不再增加,现象可判断反应基本完成,反应结束后须立即倒入事先准备好的冰水中的原因乙酰苯胺的熔点较高,稍冷即会固化,凝固在烧瓶中难易倒出.
(6)洗涤乙酰苯胺粗品最合适的试剂是a.
a.用少量冷水洗 b.用少量热水洗c.先用冷水洗,再用热水洗 d.用酒精洗
(7)该实验最终得到纯品1.8g,则乙酰苯胺的产率是24%.
5.将AgCl分别加入盛有:①5mL水;②6mL 0.5mol/L NaCl溶液;③10mL 0.2mol/L CaCl2溶液;④10mL 0.1mol/L AgNO3的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是( )
| A. | ④①②③ | B. | ④③②① | C. | ④①③② | D. | ②③①④ |
2.X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列有关说法正确的是( )
| A. | 若mXa+与nYb-符合题目要求,则m+a=n-b | |
| B. | 若X的原子半径大于Y,则气态氢化物的稳定性HmX一定小于HnY | |
| C. | X,Y一定不是相邻周期元素 | |
| D. | 若X,Y处于同一周期且X离子所带电荷多于Y离子,则离子半径一定为:X>Y |
9.关于下列各装置图的叙述中,正确的是( )
| A. | 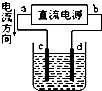 装置中,d为阳极、c为阴极 | |
| B. | 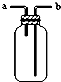 装置由a进气可用于收集H2、NH3、CO2、Cl2 等气体 | |
| C. | 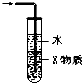 装置中X若为CCl4,可用于吸收NH3 或HCl,并可防止倒吸 | |
| D. | 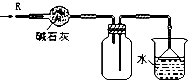 装置可用于干燥、收集HCl,并吸收多余的HCl |
19.黑火药爆炸时发生如下反应:S+2KNO3+3C→K2S+N2↑+3CO2↑,该反应中作还原剂的物质是( )
| A. | KNO3 | B. | C | C. | KNO3、S | D. | N2、CO2 |
6.用标准盐酸滴定未知浓度的NaOH溶液,下列有关实验操作的说法正确的是( )
| A. | 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 滴定过程中视线应一直注视锥形瓶内混合液颜色的变化 | |
| D. | 用酚酞做指示剂,溶液由无色变浅红色,半分钟不变色为滴定终点 |
3.能完全中和1.5molNaOH的物质是( )
| A. | 0.75mol硫酸 | B. | 0.75盐酸 | C. | 0.5mol硝酸 | D. | 0.75mol醋酸 |
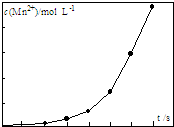 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下: