题目内容
16.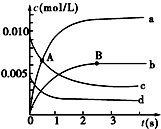 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3×10-3mol/(L•s).
(3)能说明该反应已经达到平衡状态的是ad.
a.NO、O2、NO2的浓度不变
b.v(NO)=2v(O2)c.NO、O2、NO2的分子数之比为2:1:2
d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体
c.增大O2的浓度 d.选择高效的催化剂.
分析 (1)化学反应正向进行,正反应速率大于逆反应速率,逆向进行,正反应速率小于逆反应速率;
(2)根据一氧化氮的平衡浓度仪器变化浓度计算氧气的平衡浓度,根据公式v=$\frac{△c}{△t}$计算化学反应速率;
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)一般增大反应物的浓度、增大压强,升高温度、使用催化剂,化学反应速率加快,以此来解答.
解答 解:(1)根据反应中,一氧化氮的浓度逐渐减小得到反应是正向进行建立平衡的,所以A点正反应速率大于逆反应速率,随着反应的进行,反应物的浓度减小,反应速率减慢,故答案为:大于;大于;
(2)反应中一氧化氮的浓度变化量是$\frac{0.02mol-0.007mol}{2L}$=0.0065mol/L,所以氧气的浓度减小量是0.00375mol/L,即为d曲线,从0~2s内该反应的一氧化氮浓度减小
$\frac{0.02-0.008}{2}$mol/L=0.006mol/L,二氧化氮的浓度变化量是0.006mol/L,所以用NO2表示从0~2s内该反应的平均速率v=$\frac{0.006mol/L}{2s}$=3×10-3mol/(L•s)
故答案为:d;3×10-3mol/(L•s);
(3)a.NO、O2、NO2的浓度不变是化学平衡的特征,故a正确;
b.v(NO)=2v(O2)不能说明正逆反应速率相等,反应不一定平衡,故b错误;
c.NO、O2、NO2的分子数之比为2:1:2的状态不能说明正逆反应速率相等,此时的状态不一定时平衡状态,故c错误;
d.v逆(NO2)=2v正(O2)说明正逆反应速率是相等的,所以该状态是平衡状态,故d正确.
故选ad;
(4)a.适当升高温度可以加快反应速率,故正确;
b.及时分离出NO2气体,会降低反应速率,故错误;
c.增大O2的浓度可以加快反应速率,故错误;
d.选择高效的催化剂可以加快反应速率,故正确.
故选acd.
点评 本题考查了化学平衡状态的判断、化学反应速率的计算等知识点,根据速率计算公式结合v(正)=v(逆)来分析解答即可,难度不大.

| A. | 物质的溶解性为难溶,即该物质的溶解度为0 | |
| B. | 不溶于水的物质,其Ksp=0 | |
| C. | 绝对不溶于水的物质是不存在的 | |
| D. | 某离子被沉淀完全是指该离子在溶液中的浓度为0 |
| A. | 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 过滤操作时,向过滤器中倾倒液体时一定要用玻璃棒引流 | |
| D. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数.
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4+□K2SO4+□H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②实验2条件下平衡常数表达式K=$\frac{c({CO}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$,该反应为放热(填“吸热”或“放热”)反应.
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-354.8kJ/mol.
| A. | NH3的水溶液能导电,所以NH3是电解质 | |
| B. | BaSO4其水溶液几乎不导电,但BaSO4是电解质 | |
| C. | 液溴不导电,所以液溴是非电解质 | |
| D. | 食盐水能导电,故其属于电解质 |
| A. | BeCl2溶液pH<7,将其蒸干、灼烧后可得残留物BeCl2 | |
| B. | Na2BeO2溶液pH>7,将其蒸干、灼烧后可得残留物Na2BeO2 | |
| C. | Be(OH)2即能溶于盐酸,又能溶于NaOH溶液 | |
| D. | BeCl2水溶液的导电性强,BeCl2一定是离子晶体 |
| A. | Na+、Fe2+ | B. | Al3+、SO42- | C. | Fe3+、SO42- | D. | Al3+、Cl- |