题目内容
11.下列说法正确的是( )| A. | NH3的水溶液能导电,所以NH3是电解质 | |
| B. | BaSO4其水溶液几乎不导电,但BaSO4是电解质 | |
| C. | 液溴不导电,所以液溴是非电解质 | |
| D. | 食盐水能导电,故其属于电解质 |
分析 根据电解质在水溶液里或熔融状态下能导电的化合物,非电解质在水溶液里和熔融状态下都不导电的化合物,单质和混合物既不是电解质,也不是非电解质.
解答 解:A、氨气在水溶液能够导电,但是导电离子不是氨气本身电离的,氨气为非电解质,故A错误;
B、BaSO4其水溶液几乎不导电,但在熔融状态下能电离而导电,所以BaSO4是电解质,故B正确;
C、液溴属于单质,不是化合物,所以不是非电解质,故C错误;
D、食盐水是氯化钠的水溶液,属于混合物,所以不是电解质,故D错误;
故选:B.
点评 本题考查电解质、非电解质的定义,题目难度不大,注意单质和混合物既不是电解质,也不是非电解质.

练习册系列答案
相关题目
2. 某反应:2A(g)?B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则( )
某反应:2A(g)?B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则( )
 某反应:2A(g)?B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则( )
某反应:2A(g)?B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则( )| A. | 乙容器中使用了比甲容器更高的温度 | |
| B. | 乙容器中加入了某种不与体系反应的气体,增大了容器内的压强 | |
| C. | 乙容器中使用了催化剂 | |
| D. | 乙容器中可能既升高了温度又使用了催化剂 |
16.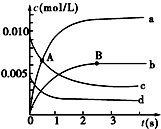 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)A点处,v(正)大于v(逆),A点正反应速率大于B点正反应速率(用“大于”、“小于”或“等于”填空).
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3×10-3mol/(L•s).
(3)能说明该反应已经达到平衡状态的是ad.
a.NO、O2、NO2的浓度不变
b.v(NO)=2v(O2)c.NO、O2、NO2的分子数之比为2:1:2
d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体
c.增大O2的浓度 d.选择高效的催化剂.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3×10-3mol/(L•s).
(3)能说明该反应已经达到平衡状态的是ad.
a.NO、O2、NO2的浓度不变
b.v(NO)=2v(O2)c.NO、O2、NO2的分子数之比为2:1:2
d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体
c.增大O2的浓度 d.选择高效的催化剂.
3. 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 配制250mL4.6mol/L的稀硫酸需取该浓硫酸62.5mL | |
| C. | 该硫酸浓度太大,不能用于干燥氨气 | |
| D. | 硫酸的摩尔质量为98g |
20.能够用来鉴别NaCl、AlCl3、FeCl2、MgCl2四种溶液的试剂是( )
| A. | NaOH | B. | AgNO3 | C. | 氨水 | D. | 稀硫酸 |
1.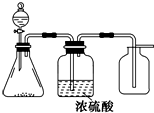 如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
 如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )| A. | 碱石灰和浓氨水 | B. | 锌和稀硫酸 | C. | 碳酸钙和稀盐酸 | D. | 铜和稀硝酸 |
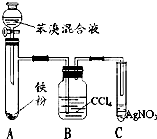 如图是制取溴苯的装置,试回答:
如图是制取溴苯的装置,试回答: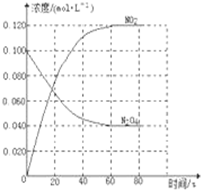 在容积为1.00L的容器中,通入一定量的N2O4,发生反应,随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应,随温度升高,混合气体的颜色变深.回答下列问题: 在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应: