题目内容
1.亚硝酸盐是一种常见的食品添加剂,使用时必须严格控制其用量.为检测某食品中亚硝酸盐含量(通常以1kg样品中含NaNO2的质量计,假定食品本身不参与反应),某研究小组设计了如下实验方案:[样品]$→_{操作}^{一系列}$[溶液A]$→_{酸钾溶液}^{①酸性高锰}$[溶液D]$→_{标准溶液滴定}^{②(NH_{4})_{2}Fe(SO_{4})_{2}}$[数据处理]
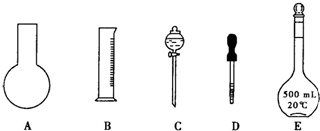
(1)实验过程中需配制500mL 0.0010mol/L (NH4)2Fe(SO4)2标准溶液,如图所示的仪器中肯定不需要的是AC(填序号),配制上述溶液还需要用到的玻璃仪器是烧杯、玻璃棒(填仪器名称).配制溶液时,定容的操作方法是向容量瓶中加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切.
(2)已知亚硝酸钠(NaNO2)的水溶液呈弱碱性,则亚硝酸的电离方程式为HNO2?H++NO2-.
(3)完成并配平实验方案中反应①的离子方程式,并用单线桥表示电子转移的方向和数目:
2MnO${\;}_{4}^{-}$+5NO${\;}_{2}^{-}$+6H+═2Mn2++5NO${\;}_{3}^{-}$+3H2O,
(4)若称取样品a g进行测定,准确量取12.00mL 0.0005mol/L的酸性KMnO4溶液(过量)与溶液A反应.反应后溶液用0.0010mol/L (NH4)2Fe(SO4)2标准溶液滴定至紫色溶液刚好褪去;重复上述实验2次,平均消耗(NH4)2Fe(SO4)2溶液10.00mL,则1kg样品中 NaNO2的质量为$\frac{690}{a}$mg (用含a的代数式表示).
分析 (1)根据溶液的配制过程,结合各仪器的作用选取仪器,定容方法是向容量瓶中加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切;
(2)已知亚硝酸钠(NaNO2)的水溶液呈弱碱性,说明是强碱弱酸盐,溶液中亚硝酸根离子水解,亚硝酸为弱酸;
(3)依据氧化还原反应电子守恒,结合元素化合价变化升降守恒配平书写离子方程式;
(4)利用高锰酸钾氧化亚硝酸根离子为硝酸根离子,过量的高锰酸钾被硫酸亚铁铵还原恰好反应,结合离子方程式的定量关系计算得到.
解答 解:(1)用容量瓶配制溶液,用胶头滴管定容;还需要用到的仪器有:溶解或稀释药品的烧杯、搅拌或引流用的玻璃棒,配制溶液时,定容的操作方法是,向容量瓶中加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切,
故答案为:AC;烧杯和玻璃棒;向容量瓶中加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切;
(2)已知亚硝酸钠(NaNO2)的水溶液呈弱碱性,说明是强碱弱酸盐,溶液中亚硝酸根离子水解,亚硝酸为弱酸,亚硝酸的电离方程式为:HNO2?H++NO2-,
故答案为:HNO2?H++NO2-;
(3)依据氧化还原反应元素化合价变化,锰元素化合价从+7价变化为+2价锰离子,氮元素化合价从+3价变化为+5价,依据化合价变化升降相同和原子守恒配平写出离子方程式为:2MnO4-+5NO2-+6H+=2 Mn2++5NO3-+3H2O;
故答案为:2;5;6;2;5;3;
(4)依据反应过程和离子方程式可知
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
1 5
2×10-6mol 0.0010mol/L×0.01L
与亚硝酸根离子反应的高锰酸钾物质的量=0.012.00L×0.0005mol/L-2×10-6mol=4×10-6mol;
2MnO4-+5NO2-+6H+=2 Mn2++5NO3-+3H2O;
2 5
4×10-6mol 10-5mol
ag样品含 NaNO2的质量为69g/mol×10-5mol=6.9×10-4g;
1000g样品中含NaNO2的质量=$\frac{6.9×1{0}^{-4}mol×1000g}{ag}$=$\frac{0.69}{a}$g=$\frac{690}{a}$mg;
故答案为:$\frac{690}{a}$.
点评 本题考查了反应流程的分析判断,氧化还原反应的离子方程式书写和配平,物质性质的分析应用,滴定实验过程分析计算应用是解题关键,题目难度中等.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 1 mol Cu2S参加反应时有10 mol电子转移 | |
| B. | 参加反应的n(Cu2S):n(HNO3)=1:5 | |
| C. | 反应中Cu2S作还原剂 | |
| D. | 产物n[Cu(NO3)2]:n[CuSO4]=l:1 |
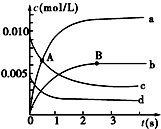 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示O2变化的曲线是d.用NO2表示从0~2s内该反应的平均速率v=3×10-3mol/(L•s).
(3)能说明该反应已经达到平衡状态的是ad.
a.NO、O2、NO2的浓度不变
b.v(NO)=2v(O2)c.NO、O2、NO2的分子数之比为2:1:2
d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是acd.
a.适当升高温度 b.及时分离出NO2气体
c.增大O2的浓度 d.选择高效的催化剂.
| A. | 一个小黑点表示一个电子 | B. | 黑点的多少表示电子个数的多少 | ||
| C. | 表示电子运动的轨迹 | D. | 电子在核外空间出现机会的多少 |
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 | 产生大量白烟 | 氨气与氯化氢反应 |
| B | 将洁净铁片放入浓硫酸或浓硝酸中 | 无明显变化 | 常温下,浓硫酸、浓硝酸使铁片钝化 |
| C | 在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中 | 产生苍白色火焰 | 物质燃烧不一定需要氧气 |
| D | 加热试管中的氯化铵固体 | 试管底部的固体逐渐消失 | 氯化铵受热升华 |
| A. | A | B. | B | C. | C | D. | D |
 和
和
 与
与 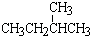 ; ⑧35Cl和37Cl
; ⑧35Cl和37Cl