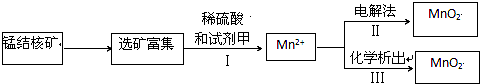
题目内容
1.下列各溶液中能大量共存的离子组是( )| A. | 在碱性溶液中:Na+,NO3-,S2-,SO32- | |
| B. | 使pH试纸呈红色的溶液中:Fe2+,I-,NO3-,Cl- | |
| C. | 碳酸氢钠溶液中:K+,SO42-,Cl-,H+ | |
| D. | 使酚酞试液呈红色的溶液中:Mg2+,Cu2+,SO42-,K+ |
分析 A.碱性条件下,离子之间不反应且和氢氧根离子不反应的能大量共存;
B.使pH试纸呈红色的溶液为酸性溶液,酸性条件下硝酸根离子具有强氧化性,能氧化还原性离子;
C.离子之间不反应且和碳酸氢根离子不反应的能大量共存;
D.使酚酞试液呈红色的溶液为碱性溶液,离子之间不反应且和氢氧根离子不反应的能大量共存.
解答 解:A.碱性条件下,这几种离子之间不反应且和氢氧根离子不反应,所以能大量共存,故A正确;
B.使pH试纸呈红色的溶液为酸性溶液,酸性条件下硝酸根离子具有强氧化性,能氧化还原性离子亚铁离子生成铁离子,能氧化碘离子生成碘单质,所以不能大量共存,故B错误;
C.碳酸氢根离子和氢离子反应生成二氧化碳和水,所以不能大量共存,故C错误;
D.使酚酞试液呈红色的溶液为碱性溶液,Cu2+、OH-反应生成沉淀而不能大量共存,故D错误;
故选A.
点评 本题考查离子共存,为高频考点,侧重考查复分解反应和氧化还原反应,明确离子性质是解本题关键,易错选项是B.

练习册系列答案
相关题目
9.常温下,在①纯水,②pH=3的盐酸,③pH=3的NH4Cl,④pH=11的NaOH溶液中,水的电离度大小为( )
| A. | ①=②=③=④ | B. | ③>②=④>① | C. | ③>①>②=④ | D. | ④=②>①=③ |
16.下列反应中,水既做氧化剂又做还原剂的是( )
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | B. | Na2O+H2O═2NaOH | ||
| C. | SO2+H2O═H2SO3 | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
6.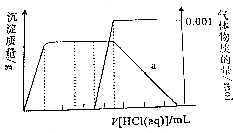 某溶液中只可能含有CO32-、AlO2-、Fe3+、Na+、SiO32-、NH3•H2O中的几种粒子,在振荡情况下,不断滴入稀盐酸,根据实验现象作出如下图象:则对该溶液的下列判断正确的是( )
某溶液中只可能含有CO32-、AlO2-、Fe3+、Na+、SiO32-、NH3•H2O中的几种粒子,在振荡情况下,不断滴入稀盐酸,根据实验现象作出如下图象:则对该溶液的下列判断正确的是( )
 某溶液中只可能含有CO32-、AlO2-、Fe3+、Na+、SiO32-、NH3•H2O中的几种粒子,在振荡情况下,不断滴入稀盐酸,根据实验现象作出如下图象:则对该溶液的下列判断正确的是( )
某溶液中只可能含有CO32-、AlO2-、Fe3+、Na+、SiO32-、NH3•H2O中的几种粒子,在振荡情况下,不断滴入稀盐酸,根据实验现象作出如下图象:则对该溶液的下列判断正确的是( )| A. | 溶液呈碱性,一定不含Fe3+、和NH3•H2O,c(CO3 2-) 为0.001mol/L | |
| B. | 与H+反应的先后次序是:AlO2-、NH3•H2O、CO32-、HCO3-、A l(OH)3 | |
| C. | 一定含有CO32-、AlO2-、Na+、NH3•H2O,可能 含有SiO32- | |
| D. | a点溶液中存在:c(Na+)+c(H+)+3c(Al3+)=c(OH-)+c(Cl-) |
4.设NA为阿伏加德岁常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,7.0g乙烯与丙烯的混合物中含有碳氢键的数目为NA | |
| C. | 50 mL18.4mol/L浓硫酸与足量铜微热反应,生成S02分子的数目为0.46NA | |
| D. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0 6NA |
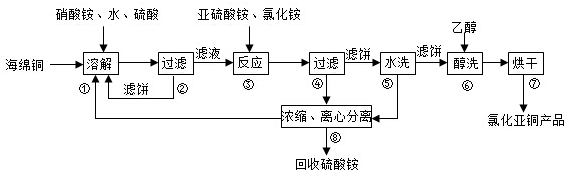
 保证食品安全、保持营养均衡,是保障人体健康的基础.
保证食品安全、保持营养均衡,是保障人体健康的基础.