题目内容
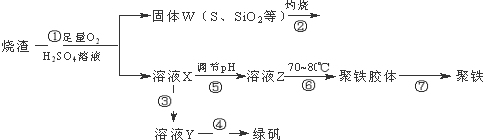
6.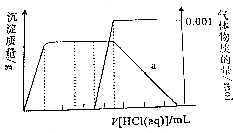 某溶液中只可能含有CO32-、AlO2-、Fe3+、Na+、SiO32-、NH3•H2O中的几种粒子,在振荡情况下,不断滴入稀盐酸,根据实验现象作出如下图象:则对该溶液的下列判断正确的是( )
某溶液中只可能含有CO32-、AlO2-、Fe3+、Na+、SiO32-、NH3•H2O中的几种粒子,在振荡情况下,不断滴入稀盐酸,根据实验现象作出如下图象:则对该溶液的下列判断正确的是( )| A. | 溶液呈碱性,一定不含Fe3+、和NH3•H2O,c(CO3 2-) 为0.001mol/L | |
| B. | 与H+反应的先后次序是:AlO2-、NH3•H2O、CO32-、HCO3-、A l(OH)3 | |
| C. | 一定含有CO32-、AlO2-、Na+、NH3•H2O,可能 含有SiO32- | |
| D. | a点溶液中存在:c(Na+)+c(H+)+3c(Al3+)=c(OH-)+c(Cl-) |
分析 有图象可知,加入盐酸立刻产生沉淀,说明溶液中不含NH3•H2O,产生气体,说明一定含有碳酸根离子,碳酸根离子与三价铁离子能够发生双水解,所以一定不含有三价铁离子,继续加盐酸,最终沉淀都消失,说明一定不含有硅酸根离子,一定含有偏铝酸根离子,所以一定含有的离子有:CO32-、AlO2-,溶液为中性,所以一定含有钠离子,据此解答.
解答 解:有图象可知,加入盐酸立刻产生沉淀,说明溶液中不含NH3•H2O,产生气体,说明一定含有碳酸根离子,碳酸根离子与三价铁离子能够发生双水解,所以一定不含有三价铁离子,继续加盐酸,最终沉淀都消失,说明一定不含有硅酸根离子,一定含有偏铝酸根离子,所以一定含有的离子有:CO32-、AlO2-,溶液为中性,所以一定含有钠离子,
所以溶液中一定含有的离子为:CO32-、AlO2-、Na+,
依据CO32-~CO2,产生二氧化碳0.001mol,说明含有碳酸根离子的物质的量为0.001mol;
A.碳酸钠、偏铝酸钠溶液为强碱弱酸盐,水解呈碱性,溶液中一定不含有Fe3+、和NH3•H2O,溶液体积未知无法计算c(CO3 2-),故A错误;
B.与H+反应的先后次序是:NH3•H2O、AlO2-、CO32-、HCO3-、A l(OH)3 ,故B错误;
C.一定含有的离子为:CO32-、AlO2-、Na+,如果存在硅酸根离子,加入过量盐酸会产生硅酸沉淀,最后沉淀物质的量不能为0,所以一定不含硅酸根离子,故C错误;
D.a点处含有离子为:钠离子、氢离子、铝离子、氢氧根离子、氯离子,依据溶液呈电中性,结合电荷守恒定律可知:c(Na+)+c(H+)+3c(Al3+)=c(OH-)+c(Cl-),故D正确;
故选:D.
点评 本题为离子推断题,明确离子的性质,明确图象中各段的含义是解题关键,注意离子反应先后顺序,题目难度中等.

| A. |  | B. | KSCN | ||
| C. |  | D. | NH4NO3 |
| A. | 在碱性溶液中:Na+,NO3-,S2-,SO32- | |
| B. | 使pH试纸呈红色的溶液中:Fe2+,I-,NO3-,Cl- | |
| C. | 碳酸氢钠溶液中:K+,SO42-,Cl-,H+ | |
| D. | 使酚酞试液呈红色的溶液中:Mg2+,Cu2+,SO42-,K+ |
2A(g)+B(g)?2C(g),若经 2s(秒)后测得C的浓度为0.6mol•L-1,现有下列几种说法,其中正确的是( )
| A. | 用物质 A 表示的反应的平均速率为 0.3 mol•L-1•s-1 | |
| B. | 用物质 B 表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| C. | 2 s 时物质 A的转化率为70% | |
| D. | 2 s 时物质 B的浓度为 0.7 mol•L-1 |