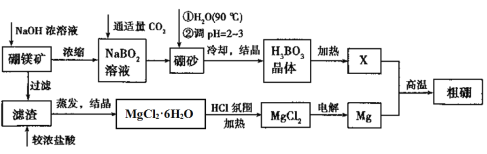
题目内容
【题目】(1)标准状况下:① 0.3mol氨气 ②6.02×1022个CO2分子 ③7.3gHCl ④ 0.2molCH4 。其中体积最大的是______;密度最大的是_____;质量最大的是_____。(填序号)
(2)相同质量的SO2与SO3,其物质的量之比为_________,氧元素的质量之比为_________,原子总数之比为____________。
(3)100mL 1 mol·L-1Al2(SO4)3溶液中含SO42-离子______个,含Al3+离子______mol。
【答案】① ② ③ 5:4 5:6 15:16 1.806×1023 (或0.3NA) 0.2;
【解析】
(1)根据n=![]() 计算CO2分子的物质的量,根据n=
计算CO2分子的物质的量,根据n=![]() 计算HCl的物质的量,根据m=nM计算氨气、二氧化碳、甲烷的质量,相同条件下,体积之比等于物质的量之比,据此判断体积大小;相同条件下,密度之比等于相对分子质量之比,据此判断密度大小;根据计算的氨气、二氧化碳、甲烷的质量,据此判断质量大小;
计算HCl的物质的量,根据m=nM计算氨气、二氧化碳、甲烷的质量,相同条件下,体积之比等于物质的量之比,据此判断体积大小;相同条件下,密度之比等于相对分子质量之比,据此判断密度大小;根据计算的氨气、二氧化碳、甲烷的质量,据此判断质量大小;
(2)根据n=![]() 可知,相同质量的SO2与SO3,其物质的量之比与摩尔质量成反比,根据SO2与SO3分子中含有O原子数目,结合SO2与SO3的物质的量之比,利用m=nM计算判断氧元素的质量之比等于氧原子数目之比;根据SO2与SO3分子中含有原子数目,结合SO2与SO3的物质的量之比,判断原子的物质的量之比;
可知,相同质量的SO2与SO3,其物质的量之比与摩尔质量成反比,根据SO2与SO3分子中含有O原子数目,结合SO2与SO3的物质的量之比,利用m=nM计算判断氧元素的质量之比等于氧原子数目之比;根据SO2与SO3分子中含有原子数目,结合SO2与SO3的物质的量之比,判断原子的物质的量之比;
(3)1molAl2(SO4)3中含铝离子2mol,硫酸根离子的物质的量为3mol,则100mL 1 mol·L-1Al2(SO4)3溶液中的物质的量为0.1L×1 mol·L-1=0.1mol,则得到SO42-离子个数,含Al3+离子的物质的量。
(1)①0.3mol氨气,质量为0.3mol×17g/mol=5.1g,②6.02×1022个CO2分子,物质的量为![]() =0.1mol,质量为0.1mol×44g/mol=4.4g,③7.3gHCl,其物质的量为
=0.1mol,质量为0.1mol×44g/mol=4.4g,③7.3gHCl,其物质的量为![]() =0.2mol,④0.2molCH4,质量为0.2mol×16g/mol=3.2g,相同条件下,体积之比等于物质的量之比,故体积最大的是:①0.3mol氨气;相同条件下,密度之比等于相对分子质量之比,CO2的相对分子质量最大,故密度最大的是:②CO2分子;由上述计算可知,质量最大的是:③7.3gHCl,
=0.2mol,④0.2molCH4,质量为0.2mol×16g/mol=3.2g,相同条件下,体积之比等于物质的量之比,故体积最大的是:①0.3mol氨气;相同条件下,密度之比等于相对分子质量之比,CO2的相对分子质量最大,故密度最大的是:②CO2分子;由上述计算可知,质量最大的是:③7.3gHCl,
故答案为①;②;③;
(2)根据n=![]() 可知,物质的量之比与摩尔质量成反比,故相同质量的SO2与SO3的物质的量之比为80g/mol:64g/mol=5:4,相同质量SO2与SO3分子中含有的氧元素的质量之比为(5×2):(4×3)=5:6,相同质量SO2与SO3分子中含有原子数目之比为(5×3):(4×4)=15:16,
可知,物质的量之比与摩尔质量成反比,故相同质量的SO2与SO3的物质的量之比为80g/mol:64g/mol=5:4,相同质量SO2与SO3分子中含有的氧元素的质量之比为(5×2):(4×3)=5:6,相同质量SO2与SO3分子中含有原子数目之比为(5×3):(4×4)=15:16,
故答案为5:4;5:6;15:16。
(3)1molAl2(SO4)3中含铝离子2mol,硫酸根离子的物质的量为3mol,则100mL 1 mol·L-1Al2(SO4)3溶液中的物质的量为0.1L×1 mol·L-1=0.1mol,则得到SO42-离子个数为0.1×3NA=0.3 NA,含Al3+离子的物质的量0.1mol×2=0.2mol,
故答案为1.806×1023 (或0.3NA);0.2。