题目内容
【题目】镁是一种重要金属,号称国防金属。某设计小组利用硼镁矿制备镁和硼的流程如下:
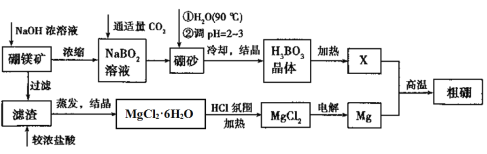
已知:硼镁矿的主要成分Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O,回答下列问题:
(1)Mg2B2O5·H2O中B的化合价为________。在90℃的热水中,加入稀硫酸调节pH=2~3生成硼酸(H3BO3),反应的离子方程式为__________。
(2)硼的化合物种类繁多,NaBH4是有机合成中常见的还原剂,NaBH4的电子式为______。
(3)将MgCl2·6H2O置于HCl氛围中加热的目的是_____,Mg与X在高温下反应的化学方程式为________。
(4)若向硼镁矿中加入0.1 mol/L盐酸溶液,充分反应后测得溶液的pH=2时,溶液中c(Mg2+)为__________________________________(忽略溶液体积的变化)。
(5)电解熔融的无水氯化镁所得的镁蒸汽在特定的环境里冷却后即为固体镁,下列物质中可以作镁蒸汽的冷却剂的是_________(填字母序号)
A氦气 B氮气
C水蒸气 D二氧化碳气体 E氯气
(6)Mg-H2O2是一种以海水为电解质(加入一定量的酸)的新型电池。该电池的负极材料为_____,正极的电极反应为________。
【答案】+3 B4O72- + 2H+ + 5H2O = 4H3BO3 ![]() 防止MgCl2水解生Mg(OH)2 B2O3+3Mg
防止MgCl2水解生Mg(OH)2 B2O3+3Mg ![]() 2B+3MgO c(Mg2+)=0.045mol/L A Mg H2O2+2e-+2H+=2H2O
2B+3MgO c(Mg2+)=0.045mol/L A Mg H2O2+2e-+2H+=2H2O
【解析】
硼镁矿的主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O.利用硼镁矿制取金属镁及粗硼的工艺流程中硼镁矿加入氢氧化钠浓溶液,过滤得到氢氧化镁,加入浓盐酸溶解通过蒸发浓缩,冷却结晶得到氯化镁结晶水合物,在氯化氢气流中加热得到氯化镁固体,电解熔融氯化镁得到镁;滤液中主要是NaBO2,通入适量二氧化碳气体得到硼砂,溶于热水后,用H2SO4调pH2~3制取H3BO3,加热得到B2O3,B2O3与镁反应生成硼,据此分析解答。
硼镁矿的主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O.利用硼镁矿制取金属镁及粗硼的工艺流程中硼镁矿加入氢氧化钠浓溶液,过滤得到氢氧化镁,加入浓盐酸溶解通过蒸发浓缩,冷却结晶得到氯化镁结晶水合物,在氯化氢气流中加热得到氯化镁固体,电解熔融氯化镁得到镁;滤液中主要是NaBO2,通入适量二氧化碳气体得到硼砂,溶于热水后,用H2SO4调pH2~3制取H3BO3,加热得到B2O3,B2O3与镁反应生成硼,
(1)Mg2B2O5·H2O中Mg元素化合价为+2价,氧元素化合价-2价,依据化合价代数和为零计算得到硼元素化合价为+3价;在90℃的热水中,加入稀硫酸调节pH=2~3生成硼酸(H3BO3),硼砂中的Na2B4O7在酸溶液中生成H3BO3 ,反应的离子方程式为:B4O72- + 2H+ + 5H2O = 4H3BO3;
故答案为:+3;B4O72- + 2H+ + 5H2O = 4H3BO3;
(2)NaBH4为离子化合物,由Na+、BH4-构成,则NaBH4的电子式为![]() ;
;
故答案为:![]() ;
;
(3)加热MgCl2·6H2O时MgCl2易水解生成氢氧化镁和氯化氢,氯化氢易挥发,则将MgCl2·6H2O置于HCl氛围中加热的目的是防止MgCl2水解生成Mg(OH)2;X为B2O3,则Mg与B2O3在高温下反应的化学方程式为B2O3+3Mg![]() 2B+3MgO;
2B+3MgO;
故答案为:防止MgCl2水解生成Mg(OH)2;B2O3+3Mg![]() 2B+3MgO;
2B+3MgO;
(4)向硼镁矿中加入0.1 mol/L盐酸溶液,发生反应Mg2B2O5H2O+4HCl═2MgCl2+2H3BO3,充分反应后测得溶液的pH=2,即氢离子0.01 mol/L,则参加反应的氢离子浓度为0.09 mol/L,设Mg2+的浓度为x mol/L,可列比例
Mg2B2O5H2O+4HCl═2MgCl2+2H3BO3
4 2
0.09mol/L x 则可列出比例式![]() ,解得x=0.045;
,解得x=0.045;
则溶液中c(Mg2+)=0.045mol/L;
故答案为:c(Mg2+)=0.045mol/L;
(5)不与氦气反应,可用作镁蒸汽的冷却剂;镁与氮气反应生成氮化镁;镁与水蒸气反应生成氢氧化镁和氢气;镁与二氧化碳反应生成碳和氧化镁;镁与氯气反应生成氯化镁;则只有氦气可用作镁蒸汽的冷却剂,A项正确;
故答案为:A;
(6)Mg为活泼金属材料,可作电池的负极材料,过氧化氢在正极得电子生成水,电极反应式为H2O2+2e-+2H+=2H2O;
故答案为:Mg;H2O2+2e-+2H+=2H2O。

【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
I (pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
II(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
IV(pH=4,含 Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是( )
A.由于Cu2+存在,IV中M的分解速率比I快
B.其它条件相同时,水样酸性越强,M的分解速率越快
C.在0~25 min内,Ⅲ中M的分解百分率比II
D.在0~20 min内,I中M的平均分解速率为0.015mol/(L·min)
【题目】已知常温下碳酸、亚硫酸、次氯酸的电离平衡常数如下表:
H2CO3 | H2SO3 | HClO |
K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
K2=5.61×10-11 | K2=1.02×10-7 |
下列说法正确的是
A. 相同条件下,同浓度的 H2SO3溶液和 H2CO3溶液的酸性, 后者更强
B. Na2CO3溶液中通入少量SO2: 2CO3 2- + SO2+ H2O = 2HCO3 - + SO3 2-
C. NaClO 溶液中通入少量CO2:2ClO- + CO2 + H2O = 2HClO + CO3 2-
D. 向氯水中分别加入等浓度的 NaHCO3 和 NaHSO3溶液,均可提高氯水中 HClO 的浓度