题目内容
【题目】硼及硼的化合物有着广泛的用途。请回答下列问题:
(1) 硼酸(H3BO3)为一元弱酸,硼酸中B的化合价为________。
(2) 已知:H3BO3的电离常数Ka=5.8×1010,H2CO3的电离常数掏Ka1=4.4×107、Ka2=4.7×1011,向饱和硼酸溶液中滴加0.1 mol·L1 Na2CO3溶液,写出发生反应的离子方程式________。
(3) 以硼酸为原料可制备重要还原剂NaBH4。NaBH4与BF3在50℃~70℃反应生成NaBF4和乙硼烷(B2H6),该反应的化学方程式是________。
(4) B2H6是强还原剂,氢元素的化合价与NaH中的氢相同。B2H6与水反应生成H3BO3和H2,若有0.1 mol电子转移时,则产生H2在标准状况下的体积为________L。
【答案】+3 CO![]() +H3BO3=HCO+H2BO或CO
+H3BO3=HCO+H2BO或CO![]() +H3BO3=HCO+BO+H2O或CO
+H3BO3=HCO+BO+H2O或CO![]() +H3BO3+H2O=HCO+B(OH) 3NaBH4+4BF3
+H3BO3+H2O=HCO+B(OH) 3NaBH4+4BF3![]() 3NaBF4+2B2H6 2.24
3NaBF4+2B2H6 2.24
【解析】
(1)H3BO3中H为+1价,O为—2价,B的化合价为化合价为+3价;
(2)H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7,因5.8×10-10<4.4×10-7,所以向饱和硼酸溶液中滴加0.1 mol·L1 Na2CO3溶液不能产生所以H2CO3,只能产生HCO3—,故离子方程式为CO![]() +H3BO3=HCO+H2BO或CO
+H3BO3=HCO+H2BO或CO![]() +H3BO3=HCO+BO+H2O或CO
+H3BO3=HCO+BO+H2O或CO![]() +H3BO3+H2O=HCO+B(OH);
+H3BO3+H2O=HCO+B(OH);
(3)反应物为NaBH4和BF3,生成物为NaBF4和B2H6,根据氧化还原反应配平方法可得方程式为:3NaBH4+4BF3![]() 3NaBF4+2B2H6;
3NaBF4+2B2H6;
(4)B2H6与水反应生成H3BO3和H2,生成1molH2 转移2mol电子,若有0.1 mol电子转移时,则产生H2 0.2mol,标准状况下的体积为2.24 L。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
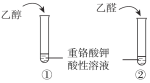
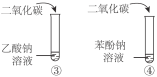
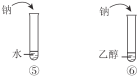
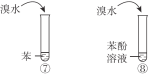
期末集结号系列答案【题目】下列实验内容能达到实验目的的是
实验目的 | 实验内容 | |
A | 鉴别乙醇与乙醛 |
|
B | 比较乙酸、碳酸、苯酚的酸性 |
|
C | 说明烃基对羟基上氢原子活性的影响 | |
D | 说明苯环对取代基上氢原子活性的影响 |
|
A. AB. BC. CD. D