题目内容
【题目】在KNO3固体样品中含有少量的KCl、BaCl2杂质,为了提纯KNO3并分离得到BaCl2,进行如下实验操作:
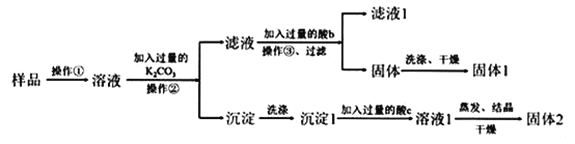
(1)加入过量K2CO3所发生反应的离子方程式为____;
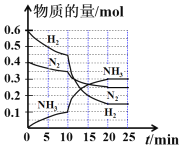
(2)结合图中各物质的溶解度曲线可知操作③的名称是____;
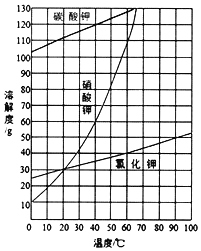
(3)有人认为操作③之前无需加入过量的酸b,也能达到实验目的,你认为该观点是否正确?并做出解释___。
(4)用制得的KNO3固体配制200mL0.2mol/LKNO3溶液。
①本实验用到的仪器有天平、药匙、玻璃棒、烧杯、量筒、还有___、___;
②下列情况会使所配制的KNO3 溶液的浓度偏高的是____(填字母)。
A.没有洗涤烧杯和玻璃棒
B.容量瓶不干燥,含有少量蒸馏水
C.定容时仰视刻度线
D.定容时俯视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
【答案】CO32-+Ba2+=BaCO3↓ 蒸发浓缩、冷却结晶 正确,由于硝酸钾的溶解度随温度降低急剧下降,因此有大量硝酸钾晶体析出,而碳酸钾溶解度很大,因而不会结晶析出 胶头滴管 250mL容量瓶 D
【解析】
样品溶解后加入过量K2CO3溶液,生成碳酸钡沉淀和氯化钾,过滤得到碳酸钡沉淀经过洗涤、再加过量的c酸溶解,根据实验目的,c酸为盐酸,反应后得到氯化钡溶液,经蒸发结晶干燥可得到固体2为氯化钡固体;由于K2CO3过量,所以滤液中的物质有KNO3、KCl和K2CO3,因此要得到纯净的KNO3就需要除去K2CO3,所以加入过量的酸b为稀硝酸最合适,K2CO3和稀硝酸生成KNO3、水和二氧化碳,所得溶液中主要为KNO3和KCl,利用溶解度随温度变化不同,操作③可以采用蒸发浓缩、冷却结晶,析出KNO3晶体,过滤、洗涤、干燥得到固体1为KNO3,据此分析解答(1)~(3);
(4)①配制200mL0.2molL-1 KNO3,应选择250mL容量瓶;
②根据c=![]() 分析操作对溶质的物质的量或对溶液的体积的影响判断。
分析操作对溶质的物质的量或对溶液的体积的影响判断。
(1)加入过量K2CO3所发生反应的化学方程式为 BaCl2+K2CO3=BaCO3↓+2KCl,反应的离子方程式为:CO32-+Ba2+=BaCO3↓,故答案为:CO32-+Ba2+=BaCO3↓;
(2)因为硝酸钾溶解度随温度变化很大,而氯化钾溶解度随温度变化很小,所以要析出硝酸钾可以采用蒸发浓缩、冷却结晶的方法,则操作③的名称是蒸发浓缩、冷却结晶,故答案为:蒸发浓缩;冷却结晶;
(3)根据溶解度曲线,由于硝酸钾的溶解度随温度降低急剧下降,因此冷却结晶有大量硝酸钾晶体析出,而碳酸钾溶解度很大,因而不会结晶析出,所以操作③之前无需加入过量的盐酸除碳酸钾;故答案为:正确,由于硝酸钾的溶解度随温度降低急剧下降,因此有大量硝酸钾晶体析出,而碳酸钾溶解度很大,因而不会结晶析出;
(4)①配制200mL0.2molL-1 KNO3,应选择250mL容量瓶,所以本实验用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、量筒、还有250mL容量瓶,故答案为:胶头滴管;250mL容量瓶;
②A.没有洗涤烧杯和玻璃棒,导致溶质部分损耗,溶液浓度偏低,故A不选;
B.容量瓶不干燥,含有少量蒸馏水,对溶液的浓度无影响,故B不选;
C.仰视观察液面与容量瓶刻度线,导致溶液体积偏大,溶液浓度偏低,故C不选; D.俯视观察液面与容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高,故D选;E.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,溶液的体积偏大,溶液浓度偏低,故E不选;
故答案为:D。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】下列有关实验操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向BaCl2溶液中通入CO2 | 产生白色沉淀 | 白色沉淀为BaCO3 |
B | 向 NaHCO3溶液中先加入CaCl2溶液,再加入NaOH溶液 | 产生白色沉淀 | 白色沉淀为CaCO3 |
C | 向某溶液加入NaOH溶液,用湿润的红色石蕊试纸检验产生的气体 | 湿润的红色石蕊试纸未变蓝 | 该溶液中一定不含有 |
D | 向某溶液中先加入HNO3溶液,再加入BaCl2溶液 | 产生白色沉淀 | 该溶液中一定含有 |
A. A B. B C. C D. D
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分。
H | He | ||||||
Li | Be | B | C | N | O | F | Ne |
Na | Mg | Al | Si | P | S | Cl | Ar |
请回答下列问题。
(1)非金属性最强的元素名称为___________,它位于元素周期表中的位置___________。
(2)硅元素的原子结构示意图是____________,其最高价氧化物是____________(填“酸性”或“碱性”)氧化物。
(3)硼酸(H3BO3)的酸性_________(填“>” 或“<”)碳酸(H2CO3)的酸性,说明你判断的理由:__________________________。
(4)NH3的电子式为________________,它属于____________(填“离子”或“共价”)化合物。NH3的还原性_________(填“>” 或“<”)PH3的还原性。
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式______________。