题目内容
7.X、Y、Z是三种气态物质,在一定温度下其变化符合如图.下列说法不正确的是( )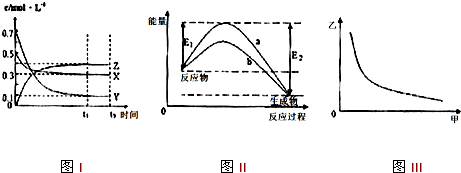
| A. | 该反应的化学方程式为X(g)+3Y(g)?2Z(g) | |
| B. | 图Ⅲ中甲表示压强,则纵坐标可表示混合气体中Z的含量或者混合气体的平均摩尔质量 | |
| C. | 若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图Ⅱ中曲线可表示有无催化剂的能量变化曲线 |
分析 A.根据图I知,随着反应进行,X、Y的物质的量浓度降低、Z的物质的量浓度升高,所以X和Y是反应物、Z是生成物,达到平衡状态时,△c(X)=(0.5-0.3)mol/L=0.2mol/L、△c(Y)=(0.7-0.1)mol/L=0.6mol/L、△c(Z)=(0.4-0)mol/L=0.4mol/L,同一反应中同一时间段内各物质浓度变化量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.2mol/L:0.6mol/L:0.4mol/L=1:3:2,据此书写方程式;
B.该反应是一个反应前后气体体积减小的可逆反应,增大压强,平衡正向移动,气体的物质的量减小,气体总质量不变,则平均摩尔质量增大;
C.若升高温度,平衡常数减小,说明平衡逆向移动;
D.催化剂降低反应所需活化能,能同等程度的改变正逆反应速率,但不影响平衡移动.
解答 解:A.根据图I知,随着反应进行,X、Y的物质的量浓度降低、Z的物质的量浓度升高,所以X和Y是反应物、Z是生成物,达到平衡状态时,△c(X)=(0.5-0.3)mol/L=0.2mol/L、△c(Y)=(0.7-0.1)mol/L=0.6mol/L、△c(Z)=(0.4-0)mol/L=0.4mol/L,同一反应中同一时间段内各物质浓度变化量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.2mol/L:0.6mol/L:0.4mol/L=1:3:2,所以反应方程式为X(g)+3Y(g)?2Z(g),故A正确;
B.该反应是一个反应前后气体体积减小的可逆反应,增大压强,平衡正向移动,则Z的含量增大;气体的物质的量减小,气体总质量不变,则平均摩尔质量增大,故B错误;
C.若升高温度,平衡常数减小,说明平衡逆向移动,则反应物Y的转化率降低,故C正确;
D.催化剂降低反应所需活化能,能同等程度的改变正逆反应速率,但不影响平衡移动,焓变不变,所以图Ⅱ中曲线可表示有无催化剂的能量变化曲线,故D正确;
故选B.
点评 本题考查图象分析,侧重考查学生分析判断能力,明确外界条件对平衡移动影响、催化剂的作用、物质的量浓度变化量与计量数之间关系是解本题关键,注意催化剂不影响平衡移动,但能影响反应速率,注意图II中是否使用催化剂不影响焓变,为易错点.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案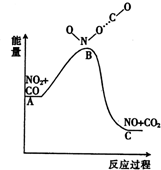
| A. | 该反应为吸热反应 | |
| B. | 该反应为非氧化还原反应 | |
| C. | NO和CO2的键能总和大于NO2和CO的键能总和 | |
| D. | 1 molNO2(g)和1 mol CO(g)的总能量低于 1mol NO(g)和1 molCO2(g)的总能量 |
| A. | 海带、紫菜等海藻类植物中含有丰富的I2 | |
| B. | 灼烧海带样品时,坩埚应该垫在石棉网上加热 | |
| C. | 可以用CCl4、裂化汽油等有机溶剂把碘萃取出来 | |
| D. | 分液漏斗中液体的总体积不得超过其容量的$\frac{2}{3}$ |
| A. | 锌粒与稀H2SO4反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 灼热的碳与CO2反应 | D. | 葡萄糖在人体内氧化 |
| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 该燃料电池的总反应方程式为:2H2+O2═2H2O | |
| C. | 工作一段时间后,电解液中的KOH的物质的量不变 | |
| D. | 工作时溶液中K+向负极移动 |

 能源与资源是现代社会发展的重要支柱.
能源与资源是现代社会发展的重要支柱.

 ,B中含有的化学键类型是离子键、共价键.
,B中含有的化学键类型是离子键、共价键.
 .
. .
.